В начале XX века в физике утвердился принцип «корпускулярно-волнового дуализма». Свет распространяется как электромагнитная волна, но линейчатый характер спекторов атома водорода, явление фотоэффекта, свидетельствует, что свет есть поток частиц, такая двойственность природы света позволили Де Бройлю в 1924 году высказать гипотезу, что всякая микрочастица (в том числе электрон) ведут двойственные свойства.
 ,
,
т.е. частица массы m двигаясь со скоростью  , может стать источником электромагнитного излучения с длиной волны
, может стать источником электромагнитного излучения с длиной волны  . Волновые свойства электронов были подтверждены в 1925 году Дейнисом и Джерлином, они наблюдали прохождение катодных лучей через кристаллы никеля, таким образом гипотеза Де Бройля нашла свое практическое подтверждение и стала основой для развития нового раздела физико- квантовой механики - изучение движения частиц.
. Волновые свойства электронов были подтверждены в 1925 году Дейнисом и Джерлином, они наблюдали прохождение катодных лучей через кристаллы никеля, таким образом гипотеза Де Бройля нашла свое практическое подтверждение и стала основой для развития нового раздела физико- квантовой механики - изучение движения частиц.
5)
1. Главное квантовое число (ввел Бор)  .
.
Физический смысл: задает размер атомной орбитали и определяет энергетический уровень электрона в атоме.
2. Орбитальное квантовое число,  .
.
Физический смысл: определяет форму атомной орбитали, энергетический уровень.
Атомная орбиталь (АО) – это область околоядерного пространства, для которой вероятность нахождения электрона составляет 95%. Каждый электрон в атоме занимает соответствующую АО, т.е. область определенного размера (n), определенной формы (l) и определенной ориентации в магнитном поле земли. АО могут быть одинакового размера, но разной формы, следовательно, размер задаст энергетический уровень, а форма – энергетический подуровень.
Численным значениям орбитального квантового числа в квантовой механике даня соответствующие буквенные значения:
Пример: n=2
l = 0 (s-орбиталь) или l = 1(p-орбиталь)
l = 2(d-орбиталь) l = 3 (f-орбиталь)
3. Магнитное квантовое число  Общее число значений магнитного квантового числа равно:
Общее число значений магнитного квантового числа равно: 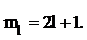
Физический смысл: определяет пространственную ориентацию в магнитном поле. В общем случае число атомных орбиталей определяется суммой значений магнитного квантового числа.
4. Спиновое квантовое число, принимает значение  . Определяет собственный магнитный момент электрона, т. е. направление вращения атомной орбитали вокруг собственной оси. На одной атомной орбитали, может находиться 2 электрона различных по значению
. Определяет собственный магнитный момент электрона, т. е. направление вращения атомной орбитали вокруг собственной оси. На одной атомной орбитали, может находиться 2 электрона различных по значению  такие электроны называются спаренными. Таким образом, энергия состояния электрона в атоме определяется размером, формой и направлением вращения АО Число электронов, которое может находиться на данном энергетическом уровне, определяется по формуле:
такие электроны называются спаренными. Таким образом, энергия состояния электрона в атоме определяется размером, формой и направлением вращения АО Число электронов, которое может находиться на данном энергетическом уровне, определяется по формуле: 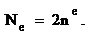
Принцип Паули говорит, что в атоме не может быть двух электронов, имеющих одинаковый набор 4-х квантовых чисел.

| 
|

| 
|

| 
|

| 
|

Значит, на одной АО могут находиться два электрона различных по значению спинового квантового числа.
6) распределение электронов в атоме по энергетическим состояниям происходит с соблюдением основного принципа устойчивости систем т. е. минимума свободной энергии из которого следует, что если в атоме есть 1 электрон, то он безусловно займет первый энергетический уровень. Этот основной принцип реализуется в квантовой механике в виде следующих правил:
Принцип Паули – в атоме не может быть двух электронов, характеризующихся одинаковым набором четырех квантовых чисел.
Правило Хунда:
Если имеется в атоме несколько электронов, находящихся на одном энергетическом подуровне, то состоянию с меньшей энергией соответствует использованию большего числа орбиталей. (Устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атома максимально).
Правило Клечковского:
При увеличении заряда ядра атома последовательное заполнение орбиталей происходит от орбитали с меньшим значением суммы главного квантового числа и орбитального квантового числа (n+l) к орбиталям с большим значением суммы.
7) Периодические изменения свойств химических элементов обнаруженные Д. И. Менделеевым можно объяснить, рассматривая электронную структуру атомов.
Положение химического элемента в периодической системе соответствует электронному строению его атома, при этом в одной группе оказываются элементы, имеющие одинаковое число электронов на внешнем энергетическом уровне. Всякие элементы в периодической системе находятся на пересечении горизонтального и вертикального ряда. Номер группы соответствует числу электронов на внешнем энергетическом уровне атома, а номер периода совпадает с числом энергетических уровней в атоме и указывает номер внешнего энергетического уровня.
Период – это горизонтальный ряд электронов, расположенных по возрастанию атомной массы, заряда ядра, числа электронов в атоме, начинающийся с типичного металла и заканчивающийся инертным газом  свойства атомов определяются строением внешнего энергетического уровня, т. е. числом электронов на этом уровне и номером этого уровня. Номер уровня определяет расстояние электрона от ядра. Таким образом, свойства элементов изменяются периодически в связи с тем, что периодически повторяется структура внешнего энергетического уровня атома. В периоде с ростом порядкового номера идет формирование нового энергетического уровня, и при переходе от предыдущего к последующему число электронов возрастает, увеличивается энергия взаимодействия внешнего электрона с ядром атома, а значит, уменьшается способность атомов отдавать электроны, может быть количественно выражено потенциалом ионизации. Такие атомы с одинаковой структурой внешнего энергетического уровня находятся в одной группе и обладают сходными свойствами. Электроны внешних энергетических уровней называются валентными электронами. Именно они определяют способность атомов к взаимодействию с другими атомами. Элементы, находящиеся в 1-3 группе вступая во взаимодействие, отдают электроны и при этом превращаются в положительно заряженные ионы (катионы), приобретая устойчивую восьми электронную оболочку.
свойства атомов определяются строением внешнего энергетического уровня, т. е. числом электронов на этом уровне и номером этого уровня. Номер уровня определяет расстояние электрона от ядра. Таким образом, свойства элементов изменяются периодически в связи с тем, что периодически повторяется структура внешнего энергетического уровня атома. В периоде с ростом порядкового номера идет формирование нового энергетического уровня, и при переходе от предыдущего к последующему число электронов возрастает, увеличивается энергия взаимодействия внешнего электрона с ядром атома, а значит, уменьшается способность атомов отдавать электроны, может быть количественно выражено потенциалом ионизации. Такие атомы с одинаковой структурой внешнего энергетического уровня находятся в одной группе и обладают сходными свойствами. Электроны внешних энергетических уровней называются валентными электронами. Именно они определяют способность атомов к взаимодействию с другими атомами. Элементы, находящиеся в 1-3 группе вступая во взаимодействие, отдают электроны и при этом превращаются в положительно заряженные ионы (катионы), приобретая устойчивую восьми электронную оболочку.
8) Потенциал ионизации – это энергия, которую необходимо сообщить атому, чтобы превратить его в положительно заряженный ион. В периоде с увеличением порядкового номера потенциалы ионизации атомов возрастают, т. е. способность атомов отдавать электроны уменьшается. Атомы с выраженной способностью отдавать электроны обладают металлическими свойствами, т. е. для них характерен металлический блеск, высокая электропроводность, пластичность, и, вступая во взаимодействие с другими химическими элементами, они отдают электроны, превращаясь в катионы. Металлические свойства в периоде ослабевают, а в группе увеличиваются. Атомные радиусы химических элементов в периоде уменьшаются, т. к. увеличивается число электронов на внешнем электронном уровне и растет энергия взаимодействие с ядром. Элементы внешние энергетические уровни, которых содержат, только S-электроны называются S-элементами. Они находятся в 1 и 2 группе главной подгруппы, это типичные металлы и их валентность, т. е. способность взаимодействовать с определённым числом атомов водорода равна номеру группы. Элементы, у которых при переходе от предыдущего к последующему формируется, P-подуровни называются P-элементами. P-элементы 3 группы являются амфотерными, т. е. обладают свойствами металлов и неметаллов. Элементы 5,6,7 групп – это типичные неметаллы, т. е. вступая в соединение, принимают электроны, превращаясь в анионы, для них характерна отрицательная степень окисления (для металлов положительная). Их высшая положительная степень окисления равна номеру группы в которой они находятся, максимальная отрицательная степень окисления равна 8. Все элементы кроме O2 могут как отдавать, так и принимать электроны, в зависимости от того с каким элементом они взаимодействуют. В периодической системе имеется 3 малых и 4 больших периода (большие периоды состоят из двух рядов).
 Идёт формирование d-подуровней, формируется от предыдущего к последующему предвнешние энергетические уровни. Имея два или один электрон на внешнем энергетическом уровне, все они являются металлами, их называют d-элементами. У большинства из них d-подуровни являются не завершёнными, поэтому они:
Идёт формирование d-подуровней, формируется от предыдущего к последующему предвнешние энергетические уровни. Имея два или один электрон на внешнем энергетическом уровне, все они являются металлами, их называют d-элементами. У большинства из них d-подуровни являются не завершёнными, поэтому они:
1)Могут обладать переменной валентностью;
2)Обладают специфическими физическими свойствами (например, электропроводность) за счёт вакантных d-орбиталей.
В 6 периоде от La – Lu и в 7 от Ac – Lr формируются подуровни f:
 La – Lu (4f), Ac – Lr (5f). Их называют f-элементы. Из отдельной клеточки они вынесены в отдельную строку, их называют лантаноиды и актиноиды. Это металлы. Работа отрыва электрона от отрицательно заряженного иона, измеренная спектрально или методом Франка и Герца, характеризует сродство к электрону. Сродство к электрону E и первый потенциал ионизации I1 определяют химическую активность атома – его окислительные или восстановительные свойства.
La – Lu (4f), Ac – Lr (5f). Их называют f-элементы. Из отдельной клеточки они вынесены в отдельную строку, их называют лантаноиды и актиноиды. Это металлы. Работа отрыва электрона от отрицательно заряженного иона, измеренная спектрально или методом Франка и Герца, характеризует сродство к электрону. Сродство к электрону E и первый потенциал ионизации I1 определяют химическую активность атома – его окислительные или восстановительные свойства.
Один и тот же атом может принимать электроны, проявляя к ним сродство, или отдавать электроны другому атому, у которого сродство к электрону больше.
Электроотрицательность позволяет оценить возможность взаимодействия между данными атомами и прогнозировать распределение зарядов электронных облаков в образующемся соединении.
Электроотрицательность представляет собой периодическую функцию, величина которой позволяет оценивать поведение атома данного элемента при химических реакциях, а также влияние этого атома на распределение электронной плотности в уже готовых молекулах.
Энергия ионизации — энергия, которую необходимо затратить для отрыва электрона от атома, находящегося в основном энергетическом состоянии; обычно выражается в электрон-вольтах. Многоэлектронные атомы имеют несколько значений энергии ионизации:
I1, I2..., соответствующих отрыву первого, второго и т. д. электронов, при этом всегда 71</2</3<....
Энергия ионизации периодически изменяется. Для элементов каждого периода она возрастает слева направо с увеличением заряда ядра; в главных подгруппах уменьшается сверху вниз вследствие увеличения расстояния электрона от ядра, а в побочных подгруппах наблюдается более сложная закономерность (сначала уменьшается, а затем растет).
9) Образование ковалентной неполярной связи.
H+H  H2
H2

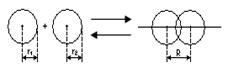

+ Q

Ковалентная связь бывает полярной и неполярной. Ковалентная неполярная связь образуется между двумя одинаковыми атомами ( ) и число таких связей в молекуле будет определяться числом не спаренных электронов во внешнем энергетическом уровне атома. Полярная ковалентная связь образуется между двумя разными атомами. Различают ковалентные связи
) и число таких связей в молекуле будет определяться числом не спаренных электронов во внешнем энергетическом уровне атома. Полярная ковалентная связь образуется между двумя разными атомами. Различают ковалентные связи  и ковалентные связи
и ковалентные связи  .
.
Сигма связь – это связь, образующаяся при таком перекрывании атомных орбиталей, когда область максимальной орбитальной плоскостью лежит на прямой соединяющей центры атомов.
 связь – образуется при таком перекрывании
связь – образуется при таком перекрывании  атомных орбиталей, когда область максимальной электронной области находится над и под плоскостью, в которой лежит прямая соединяющая центры атомов.
атомных орбиталей, когда область максимальной электронной области находится над и под плоскостью, в которой лежит прямая соединяющая центры атомов.


 + Q
+ Q

H2O

Для молекулы воды угол 105,5° вместо 90° между орбиталями атома кислорода получается за счёт взаимного отталкивания атомов водорода, входящих в состав молекулы воды.
10) Свойства ковалентной связи:
1. Всякая ковалентная связь может быть охарактеризована энергией (Q) и длиной связи.
2. Ковалентная связь бывает полярной и неполярной:
а) Ковалентная неполярная связь образуется между двумя одинаковыми атомами ( ) и число таких связей в молекуле будет определяться числом не спаренных электронов во внешнем энергетическом уровне атома. Полярная ковалентная связь образуется между двумя разными атомами.
) и число таких связей в молекуле будет определяться числом не спаренных электронов во внешнем энергетическом уровне атома. Полярная ковалентная связь образуется между двумя разными атомами.

При образовании полярной ковалентной связи общая электронная пара, за счёт которой образована связь, смещена в ту сторону, где большая Электроотрицательность связи.
Ионная связь.
В случае если ковалентная связь образуется между атомами, Электроотрицательность которых имеет большое различие. Электроотрицательность увеличивается в периодах с ростом заряда ядра и уменьшается в группах. В этом случае атомы ионизируются и удерживаются вместе за счёт электростатического взаимодействия ионов.
Ионная связь не насыщена, не направлена, её длина определяется расстоянием между ионами кристаллической решётки. Для соединений ионной связи характерны высокие температуры плавления, кипения, при стандартных условиях эти соединения находятся в кристаллическом виде.
Соединения с неполярной ковалентной связью не склонны к межмолекулярным взаимодействиям и в целом к взаимодействиям. Для их активизации необходимо разрушение, путём внешних воздействий. При стандартных условиях находятся в газообразных состояниях. Сходство ковалентной и ионной связи образуется за счет валентных электронов.
11)
Металлическая связь – это связь между атомами металлов осуществляемая за счёт всех валентных электронов атомов данной массы металла. Как и ковалентная данная связь осуществляется за счёт валентных электронов. Длина такой связи, её энергия не могут являться характеристикой связи, но по их величине можно судить по характеристикам кристаллической решётки металлов (например, расстояние между атомами или энергия кристаллической решётки). Металлическая связь не насыщена, не направлена т. к. ею связаны n-ное число атомов. Именно электроны, образовавшие металлическую связь, обуславливают физические и химические свойства металлов. Физические: электропроводность, теплопроводность, пластичность; химические: способность отдавать электроны (все металлы восстановители, но, безусловно, их восстановительные свойства для каждого индивидуальны и могут быть количественно оценены). Электролиты – это кислоты, основания, соли, в водных растворах которых присутствуют катионы и анионы, которые обуславливают их теплопроводность.
Ковалентная связь (атомная связь, гомеополярная связь) — химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.
Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость — определяют химические и физические свойства соединений.
Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы. Углы между двумя связями называют валентными.
Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные.
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
Электроны тем подвижнее, чем дальше они находятся от ядер.
12) Химическая реакция – это процесс в ходе, которого из одних веществ образуются другие. 
 аА+bB=cC+dD,где
аА+bB=cC+dD,где
 А, В – формулы исходных веществ,
А, В – формулы исходных веществ,
 C, D – формулы продуктов реакции,
C, D – формулы продуктов реакции,
 a, b, c, d – стехиометрические коэффициенты в уравнении реакций, подобранные в соответствии с законом сохранения масс реагирующих веществ (она отражает количество реагирующих веществ).
a, b, c, d – стехиометрические коэффициенты в уравнении реакций, подобранные в соответствии с законом сохранения масс реагирующих веществ (она отражает количество реагирующих веществ).
В ходе химических реакций происходит разрушение одних химических связей и образование других. На разрыв связи расходуется энергия, а при образовании – выделяется. В связи с этим любая химическая реакция сопровождается энергетическим эффектом. Т.е. выделением или поглощением энергии. Эта энергия может быть затрачена или получена в различных видах:
1. тепловой;
2. электрический;
3. световой (электромагнитное излучение).
Задачами термохимической динамики являются:
1. определение физических эффектов химических реакций, в частности тепловых;
2. изменение свободной энергии системы с целью оценки возможности протекания данной реакции при данных условиях.
Внутренняя энергия системы (U) – это общий запас энергии системы, включающий энергию поступательного и вращательного движения молекулы, энергию внутримолекулярных колебаний атома, энергию движения электронов в атоме, внутриядерную энергию, т. е. все виды энергии кроме кинетической энергии движения системы как целого и его потенциальной энергии. Внутренняя энергия является функцией состояния системы, U(P,V,T,  ). Можно охарактеризовать состояние системы параметрами (P1,V1,T1,
). Можно охарактеризовать состояние системы параметрами (P1,V1,T1,  ).
).
Процесс в ходе которого меняется хотя бы один из параметров называется термодинамическим процессом. И в ходе такого процесса изменяться внутренняя энергия системы P2,V1,T1,  .
.

Изменение внутренней энергии не зависит от пути перехода системы из первого состояния во второе, а зависит только от начального (U1) и конечного (U2) значения внутренней энергии. Если закрытая система переходит из состояния 1 в состояние 2, она обменивается с внешней средой теплотой и механической энергией, затрачиваемой механической работой.
Вну́тренняя эне́ргия тела (обозначается как E или U) — это сумма энергий молекулярных взаимодействий и тепловых движений молекулы. Внутренняя энергия является однозначной функцией состояния системы. Это означает, что всякий раз, когда система оказывается в данном состоянии, её внутренняя энергия принимает присущее этому состоянию значение, независимо от предыстории системы. Следовательно, изменение внутренней энергии при переходе из одного состояния в другое будет всегда равно разности между ее значениями в конечном и начальном состояниях, независимо от пути, по которому совершался переход.
Энтальпи́я, также тепловая функция и теплосодержание — термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц.
Проще говоря, энтальпия - это та энергия, которая доступна для преобразования в теплоту при определенных температуре и давлении.
Если термомеханическую систему рассматривать как состоящую из макротела (газа) и поршня с грузом весом Р = p S, уравновешивающего давление газа р внутри сосуда, то такая система называется расширенной.
13) Энтропия (от греч. entropía - поворот, превращение), понятие, впервые введенное в термодинамике для определения меры необратимого рассеяния энергии. Энтропия широко применяется и в других областях науки: в статистической физике как мера вероятности осуществления какого-либо макроскопического состояния; в теории информации как мера неопределенности какого-либо опыта (испытания), который может иметь разные исходы. Эти трактовки Энтропия имеют глубокую внутреннюю связь. Например, на основе представлений об информационной Энтропия можно вывести все важнейшие положения статистической физики.
При протекании химической реакции кроме изменения энтропии самой системы необходимо учитывать её изменение в окружающей среде. Если систему и её окружение в совокупности рассматривать как единую изолированную систему, то, согласно второму закону термодинамики, для самопроизвольной химической реакции общее изменение её энтропии должно быть больше нуля:
DSобщ=DSсист+DSокр>0.
Как же вычислить изменение энтропии окружения? Удобнее всего выразить его через свойства системы. Если количество теплоты DQ передаётся от системы окружению при постоянной температуре Т, то изменение энтропии окружения можно рассчитать по формуле DSокр = DQокр /T. В то же время теплота, покинувшая систему и перешедшая в окружающую среду при постоянном давлении, равна тепловому эффекту реакции DH с обратным знаком, т. е. DQокр=-DHсист. Поэтому изменение энтропии окружения DSокр=-DНсист/T. Таким образом, общее изменение энтропии можно выразить через свойства системы:
DSобщ=DSсист-DHсист/T>0.
14) aA+bB=cC+dD
Всякая химическая реакция обратима, т.е. может протекать как в прямом, так и в обратном направлении. Поэтому в реакционной смеси всегда присутствуют как исходные вещества, так и продукты реакции. Но отношение будет зависеть от условий, в которых находятся реагирующие вещества. Все реакции обратимы, но в определенных условиях они могут протекать в определенном направлении.
Термодинамика позволяет определить направление протекания данной реакции при данных условиях (при t=const и P=const). Самопроизвольно протекают процессы связанные с уменьшением свободной энергии системы. Исходя из этого, самопроизвольно могут протекать реакции в ходе, которых уменьшается свободная энергия системы. При экзотермической реакции теплосодержание уменьшается такие реакции должны идти самопроизвольно ( ), однако данный критерий не является единственным. Изменение свободной энергии определяется также величиной ещё одной термодинамической функции – энтропией. Можно привести пример реакций, которые являются экзотермическими, но самопроизвольно не протекают.
), однако данный критерий не является единственным. Изменение свободной энергии определяется также величиной ещё одной термодинамической функции – энтропией. Можно привести пример реакций, которые являются экзотермическими, но самопроизвольно не протекают.

Термином «свободная энергия» обозначают один из двух термодинамических потенциалов:
Свободная энергия Гельмгольца, — в этом значении термин обычно употребляется в физике.
Свободная энергия Гиббса, — в этом значении термин обычно употребляется в химии и физической химии.
15) Термохи́мия — раздел химической термодинамики, в задачу которой входит определение и изучение тепловых эффектов реакций, а также установление их взаимосвязей с различными физико-химическими параметрами. Ещё одной из задач термохимии является измерение теплоёмкостей веществ и установление их теплот фазовых переходов.
Закон Гесса
Основная статья: Закон Гесса
В основе термохимических расчётов лежит закон Гесса: Тепловой эффект (∆Н) химической реакции (при постоянных Р и Т) зависит от природы и физического состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
Следствия из закона Гесса:
Тепловые эффекты прямой и обратной реакций равны по величине и противоположны по знаку.
Тепловой эффект химической реакции (∆Н) равен разности между суммой энтальпий образования продуктов реакции и суммой энтальпий образования исходных веществ, взятых с учётом коэффициентов в уравнении реакции (то есть помноженные на них).
Закон Гесса может быть записан в виде следующего математического выражения:
.
С помощью закона Гесса можно рассчитать энтальпии образования веществ и тепловые эффекты реакций, которые невозможно измерить экспериментально.
[править]
Закон Кирхгофа
Основная статья: Закон Кирхгофа (химия)
Закон Кирхгофа устанавливает зависимость теплового эффекта химической реакции от температуры: температурный коэффициент теплового эффекта химической реакции равен изменению теплоёмкости системы в ходе реакции. Закон Кирхгофа лежит в основе расчёта тепловых эффектов при разных температурах.
16) Скорость реакции.
В ходе реакции постоянно изменяется количество реагирующих веществ в соответствии с их стехиометрическими отношениями, поэтому для контроля скорости достаточно определять количество хотя бы одного из реагирующих веществ, концентрацию всех других можно рассчитать из уравнения реакции, то все остальные будут изменяться в соответствии с уравнением:

 , где
, где

 - изменение концентрации одного из участников концентрации;
- изменение концентрации одного из участников концентрации;

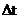 - промежуток времени, за который это изменение произошло;
- промежуток времени, за который это изменение произошло;
 v - скорость реакции.
v - скорость реакции.

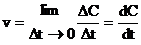 - мгновенная скорость реакции.
- мгновенная скорость реакции.
 Зависимость скорости реакции от концентрации выражается законом «действующих масс»: скорость реакции прямо пропорционально произведению концентраций реагирующих веществ, в степенях равных стехиометрическим коэффициентам в уравнениях реакций.
Зависимость скорости реакции от концентрации выражается законом «действующих масс»: скорость реакции прямо пропорционально произведению концентраций реагирующих веществ, в степенях равных стехиометрическим коэффициентам в уравнениях реакций.

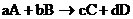

 -кинетическое уравнение реакции, где
-кинетическое уравнение реакции, где
 k- константа скорости.
k- константа скорости.
 Идеальная скорость реакции, при С(А)=С(В)=1моль/л: k=v.
Идеальная скорость реакции, при С(А)=С(В)=1моль/л: k=v.
 Константа скорости зависит от природы реагирующих веществ, от температуры.
Константа скорости зависит от природы реагирующих веществ, от температуры.

Влияние температуры на скорость реакции грубо определяется правилом Вант Гоффа. При повышении температуры на каждые 10˚С скорость реакции в среднем увеличится в 2-4 раза.
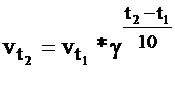
 скорость реакции при температуре
скорость реакции при температуре  ;
;
 - скорость реакции при температуре
- скорость реакции при температуре  ;
;
 - температурный коэффициент реакции, который изменяется от 2 до 4.
- температурный коэффициент реакции, который изменяется от 2 до 4.
Точно, зависимость скорости реакции от температуры выражается правилом Аррениуса.

K – константа скорости
A – эмпирический коэффициент
e – основание натурального логарифма
Eакт – энергия активации
R – газовая постоянная
T – абсолютная температура
Энергия активации – избыточная энергия, необходимая для того, чтобы столкновения между реагирующими частицами были эффективными и заканчивались их взаимодействием.
17) Средняя скорость реакции равна изменению концентрации реагирующих веществ в единицу времени (в пределах некоторого промежутка времени дельта t).
V = - дельтаC / дельта t Это формула средней скорости по одному из исходных веществ - изменение концентрации этого вещества за промежуток времени дельта t. Знак минус поставлен, чтобы скорость не была отрицательной, поскольку дельтаС - отрицательная величина, концентрация исходного вещества убывает по ходу реакции.
Если записывать скорость через концентрацию любого из продуктов реакции, то знак минус не нужен, потому что концентрация продукта реакции возрастает со временем.
Таким образом, скорость реакции можно записать через изменение концентрации ЛЮБОГО из реагирующих веществ в единицу времени.
Если вместо дельта С / дельта t записать производную (предел этого отношения при дельта t стремится к нулю), то будет не средняя, а мгновенная скорость реакции.
Средняя скорость реакции равна изменению концентрации реагирующих веществ в единицу времени (в пределах некоторого промежутка времени дельта t).
V = - дельтаC / дельта t Это формула средней скорости по одному из исходных веществ - изменение концентрации этого вещества за промежуток времени дельта t. Знак минус поставлен, чтобы скорость не была отрицательной, поскольку дельтаС - отрицательная величина, концентрация исходного вещества убывает по ходу реакции.
Если записывать скорость через концентрацию любого из продуктов реакции, то знак минус не нужен, потому что концентрация продукта реакции возрастает со временем.
Таким образом, скорость реакции можно записать через изменение концентрации ЛЮБОГО из реагирующих веществ в единицу времени.
Если вместо дельта С / дельта t записать производную (предел этого отношения при дельта t стремится к нулю), то будет не средняя, а мгновенная скорость реакции.
18)
Реакция может протекать как в прямом, так и в обратном направлении.

Кинетическое уравнение для прямой и обратной реакции

Состояние реакции системы, при котором скорость прямой реакции равна скорости обратной, называется состоянием химического равновесия. Любая реакция, протекающая в данных условиях в определенный момент времени достигнет состояния равновесия. Состояние равновесия характеризует величина – константа равновесия (Кр).

Константы равновесия показывает, что в условии равновесия концентрации всех веществ взаимосвязаны, их называют равновесными. Кроме того, если К>1, то в условии равновесия в реакционной смеси преобладают продукты реакции, а если K<1 – исходные вещества. Следовательно, при определении условий обеспечивающих равновесия с K>1, определяют возможность использования данной реакции для получения продуктов реакции.
Смещение равновесий.
Всякое равновесное состояние определяется постоянством условий (T, p, V, концентрации). Если изменить одно из этих условий, равновесие будет нарушено. Скорость прямой не равно скорости обратной реакции. Но с течением времени будет достигнуто новое состояние равновесия, т. е. скорость прямой равно скорости обратной реакции, но это будут другие скорости, Кр1= Кр2, изменятся равновесные концентрации (С1(A)≠C2(A)). Система из одного состояние равновесия перейдет в другое состояние равновесия (смещение равновесий). Поиск условий проведения реакции, при которых константы равновесия больше единицы, сводится к смещению равновесий. Для этого используется принцип Ле-Шателье. Если на систему, находящуюся в равновесии, оказывают воздействие (изменение концентрации, температуры, давления или объёма), то система увеличивает скорость тех процессов, которые направлены на снижение уровня произведенного на систему воздействия.
В настоящее время реакции проводятся с помощью катализатора. Катализатор – это вещество, которое увеличивает скорость реакции за счет образования промежуточных продуктов реакции (реакция проходит в несколько стадий, причем каждая стадия имеет меньшую энергетическую активацию). В продуктах реакции катализатор отсутствует. В результате реакция не изменяется, однако, его поверхность дезактивируется, и периодически проводят его регенерацию (восстанавливают активность катализатора).
Принцип Ле-Шателье - внешнее воздействие на систему, находящуюся в состоянии равновесия, приводит к смещению этого равновесия в направлении, при котором эффект произведенного воздействия ослабляется.
Увеличение давления смещает равновесие в сторону реакции, ведущей к уменьшению объема.
Повышение температуры смещает равновесие в сторону эндотермической реакции.
Увеличение концентрации исходных веществ и удаление продуктов из сферы реакции смещают равновесие в строну прямой реакции.
Катализаторы не влияют на положение равновесия.
19) Раствор - однородная смесь двух или более компонентов относительное содержание которых изменяется во всех объемных пределах и может изменятся в широких пределах.
1) Массовая доля растворённого вещества (ω(В), где В – формула растворённого вещества)

На практике можно измерить плотность любого раствора (ρ) используя ареометр.

2) Молярная концентрация.

3) Ковалентная концентрация

 - моляльность.
- моляльность.
Применение закона эквивалента для реакции идущих в растворах.
Пример: реакция нейтрализации: ее используют для определения содержания кислот или щелочей в различных жидких системах, путем определения их концентрации.
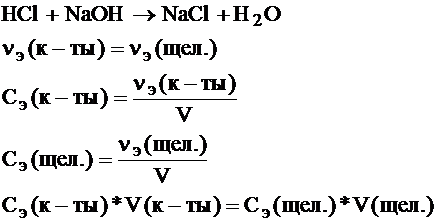
20)
Законы Рауля.
1. Тонаскапический закон: понижение давления (∆p) насыщенного пара над раствором по сравнению с чистым растворителем прямопропорционален числу моль растворенного вещества и обратно пропорционален количеству растворителя.

p0 – давление насыщенного пара над растворителем (например вода), p - давление насыщенного пара над раствором, n – количество растворенного вещества, N – количество растворителя.
2. Эбулиоскапический – повышение температуры кипения раствора по сравнению с чистым растворителем (∆T) прямопропорционально молярной концентрации раствора.
 ; T0 – температура кипения чистого растворителя; T – температура кипения раствора.
; T0 – температура кипения чистого растворителя; T – температура кипения раствора.
∆Tкип=Kэб Сm; Kэб=const – эбулеотостатическая константа (справочная величина характерная для растворителя).
3. Криоскопический (крио-холод) – изменение температуры замерзания раствора по сравнению с чистым растворителем пропорционален молярной концентрации.
∆Tзам=Kкр Сm  T0 – температура замерзания растворителя, T – температура замерзания раствора.
T0 – температура замерзания растворителя, T – температура замерзания раствора.
Kкр=const – криоскопическая константа (справочная величина).
Изменение температуры замерзания в смеси веществ тепловые эффекты при смешивании веществ используются в технике для приготовления систем охлаждающих жидкости.
Эти законы соблюдаются для растворов, где между молекулами растворителя распределены молекулы растворенного вещества (молекулярный раствор) и они не соблюдаются для растворов кислот, щелочей и солей.
Энергетические эффекты при растворении.
Процессы растворения – физико-химические процессы. Их физическая частота заключается в том, что растворение связано с распределением структурных единиц одного вещества между структурными единицами другого. Для этого необходимы затраты энергии.
· Теплосодержание (энтропия) увеличивается, если  >0, H2>H1,
>0, H2>H1,  ;
;
· Химическая сторона при растворении имеет место взаимодействия между молекулами растворенного вещества и растворителя. Если растворитель вода он называется гидротацией.
 2018-01-21
2018-01-21 1546
1546