Эбуллиоскопия. Кипение - это процесс интенсивного парообразования, характеризующийся непрерывным возникновением и ростом внутри жидкости пузырьков пара. Основными особенностями этого типа фазовых превращений является резкая зависимость температуры кипения от внешнего давления и наличия различных растворенных веществ и различие в составах жидкой и парообразной фаз. Основной характеристикой процесса кипения является температура кипения.
Температурой Кипения
|
Раствора Называется Р
| P0 |
Температура, при которой
жидкий раствор с данной
концентрацией растворенного
вещества При равновесии
Образует пар, давление которого равно внешнему давлению. Рассмотрим кипение жидких растворов нелетучих веществ, влияние которых проявляется, в первую очередь, в изменении температуры кипения.
Прямым следствием
| T T 1 |
| TО |
| T |
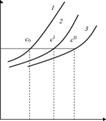
| Рис. 11.5. Давление насыщенного пара Растворителя над растворителем (1) И над растворами (2 И 3) |
Понижения давления насыщенного пара растворителя над раствором (закона Рауля) является то, что температура кипения раствора должна быть выше, чем для чистого растворителя. На рис. 11.5 изображены зависимости давления насыщенного пара растворителя (1) и растворов разной концентрации нелетучего вещества (2 И 3).Из рисунка видно, что температура кипения раствора 2, отвечающая точке пересечения изобары Р0 (внешнее давление), всегда выше температуры кипения Т0 Чистого растворителя. Разность AT = T -T0, Очевидно, тем больше, чем больше мольная доля
Растворенного нелетучего вещества. Термодинамику фазовых переходов при кипении и замерзании нагляднее всего можно представить, изображая графически зависимость химического потенциала растворителя от температуры и концентрации растворенного вещества при постоянном давлении P = Const (указание на постоянное давление очень важно потому, что температурный интервал между точками плавления (замерзания) и
Кипения определяется обязательно при одном и том же внешнем давлении Р0).
Зависимость химического потенциала от температуры для чистого вещества (в данном примере – растворителя), будучи представлена графически, имеет три кривые, соответствующие твердому, жидкому и газообразному состояниям (рис. 11.6)
 JLl
JLl
C
A
T
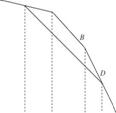
Рис. 11.6. Зависимость химического потенциала растворителя от
Температуры
| Поскольку |
'^T =-S, А S Тв < SЖидк < S Газ, то углы наклона
Касательных к зависимости jli = \I(T) Будут увеличиваться по мере
Повышения температуры (энтропия зависит от температуры), а в точках фазового перехода претерпевать изломы, поскольку при этом энтропия меняется скачкообразно. Точка А Характеризуется фазовым переходом -
Плавлением растворителя; ей соответствует температура плавления TП°,
Точка В Соответствует процессу испарения с температурой кипения T^п.
Химический потенциал растворителя при образовании раствора в соответствии с теорией идеальных растворов понижается на величину RTlnxi Под знаком логарифма должна стоять активность растворителя АХ = р\/ро\. Однако по закону Рауля для разбавленных растворов можно вместо активности записать XI = P\/Po\. Поэтому ^Раствора = jj,(T) для раствора
Пойдет ниже соответствующей зависимости для чистого растворителя. Точки пересечения этой кривой с зависимостями jli = \I(T) Для твердой и
Газообразной фаз чистого растворителя С и D Указывают, соответственно, на температуры кристаллизации ТПл и кипения Т Кип раствора. Из графика видно, что температура плавления (кристаллизации) понижается при добавлении растворенного вещества, а температура кипения увеличивается. При этом по абсолютной величине ДГпл > АТкип И
Адекватно экспериментальным данным для реальных растворов.
Запишем уравнение Клапейрона-Клаузиуса для процесса испарения в интегральной форме:
, о, АпиСп Л 1 АпиСпАТ
1п^ =---------- (—------) =----------, (11.38)
Рх R Тх Т RTXT
Где Рх, Рх, Т®,ТХ и AhИсп - соответственно давление насыщенного пара и
Температура кипения растворителя и раствора и мольная теплота испарения чистого растворителя. Применяя закон Рауля и полагая, что при
Малых AT Произведение ТХТ = (Тх0)2, Получим следующее уравнение:
ДАиспАГ
Х2 =—-—. (11.39)
RVi°)
Мольная доля растворенного вещества по причине его малой
П 2 п 2 п 2 М]
Величины может быть представлена как Х2 =----------- = — =--------, где
Пх + П2 Пх COj
CDj и Мх Соответственно навеска растворителя и его молекулярная масса.
Если навеска растворителя равна &х= 1000 г, «У 1000 = Т2 (моляльность) и
АЬисп/Мх = Х1 (удельная теплота испарения растворителя), то окончательно
Получим формулу для определения повышения температуры кипения раствора в зависимости от моляльной концентрации растворенного вещества
Ад°)
ДГ = v 1кип / Т2 =Ет2. (11.40)
2^1000
ЙГ,°) Величина Е = У ' Носит название Эбуллиоскопической
^ДООО
Постоянной (для воды Е = 0,52 °С, для бензола Е = 2,27 °С); она является постоянной для данного растворителя и не зависит от вида растворенного вещества. Формально - это величина, равная повышению температуры
Кипения раствора одного моля вещества в 1000 г растворителя, и часто называется молекулярным повышением температуры кипения. В действительности же уравнение (11.40) перестает быть правильным при высоких концентрациях растворенных веществ, поскольку в основу этого уравнения положены приближения разбавленных растворов, а также в связи с математическими упрощениями, сделанными при его выводе.
Уравнение (11.40) успешно применяется для определения молекулярной массы растворенного вещества в разбавленных растворах, поскольку мольную долю растворенного вещества можно выразить через навески его и растворителя. Тогда искомая молекулярная масса М2 растворенного вещества будет равна:
| М = 1кип 2. (11.41) |
| Д/2испДГ со |
| Кип |
Ry10 кип) M1 Со
Этот метод, использующий уравнение (11.41) для определения молекулярной массы растворенного нелетучего вещества, носит название Эбуллиоскопии.
Говоря о пределах применимости уравнений (11.40) и (11.41) следует отметить, что у многих растворов двух жидкостей пар растворителя часто можно полагать свободным от растворенного вещества, если температура кипения растворителя ниже температуры кипения растворенного вещества более чем на 100-200 °С.
Криоскопия. Процессы кристаллизации растворителя из растворов в общих чертах достаточно хорошо известны. Поэтому здесь на них мы останавливаться не будем. Покажем лишь, как решается наиболее важная в практическом отношении задача нахождения зависимости между концентрацией растворенного вещества и температурой затвердевания (кристаллизации) раствора. Связь между химическими потенциалами растворителя в двух сопряженных фазах (жидкой и твердой) определяется общими условиями равновесия, т. е.
ILЖ(T,P,X) = IlТ в(T,P). (11.42)
Особенность уравнения (11.42) состоит в том, что мольная доля первого компонента (растворителя) в твердой фазе равна единице. Часто эту фазу называют фазой постоянного состава. Используя уравнение Шредера и такую же процедуру, которую применяли для определения повышения температуры кипения разбавленных растворов, получим следующее уравнение:
^Fa)2 V
ЛГ = V 1пп Т2=Кт2, (11.43)
Р1000
Где А =---- Пл--- - Криоскопическая постоянная, P = A/Z1 /М, - удельная
РЮОО
Теплота плавления растворителя с молекулярной массой М\. Величина
Криоскопической постоянной не зависит от вида растворенного вещества,
А является функцией природы данного растворителя (для воды
Криоскопическая постоянная равна 1,85 °С, для бензола - 5,5 °С).
Уравнение (11.43) весьма часто используется подобно тому, как это
Делается в эбуллиоскопии, для определения относительной молекулярной
Массы растворенного вещества. Методика определения молекулярной
Массы растворенного вещества по понижению температуры затвердевания
Разбавленных растворов носит название Криоскопии. Выражение для
Определения относительной молекулярной массы М2 Сразу получается из
Уравнения (11.43)
ЩТ?) MI Ю9
М2= V 1пп /---- -^. (11.44)
1 затв 1
На основе уравнения (11.44) понижение температуры затвердевания может с успехом быть использовано для определения активности компонента.
Выше были рассмотрены свойства разбавленных растворов, которые не зависят от природы растворенного вещества. Растворенное вещество в этих уравнениях выступало только в виде числа молекул. Такие свойства, которые зависят только от природы растворителя, называются Коллигативными.
Билет 21.
 2018-01-21
2018-01-21 1680
1680
