ВОДОРОД (лат. Hydrogenium, от греч. hydor - вода и gennao - рождаю) Н, первый, наиб. легкий хим. элемент периодич. системы Менделеева, ат. м. 1,0794 + 0,0007 (второе слагаемое учитывает колебания изотопного состава). Прир. водород состоит из двух стабильных изотопов: протия 1Н и дейтерия 2Н, или D; содержание последнего (1,1-1,6)*10-3 ат. %; известен также радиоактивный изотоп -тритий 3Н, или Т. Ядро атома протия - протон. Атом водорода имеет один электрон, занимающий 1s1-орбиталь; степень окисления + 1 (наиб. распространена), — 1 (в гидридах щелочных металлов). Энергия ионизации Н° -> Н+ 13,595 эВ; сродство к электрону 0,75 эВ; электроотрицательность по Полингу 2,1; ат. радиус 0,046 нм.
Изотопы водорода образуют двухатомные молекулы: Н2, HEX D2, DT, НТ и Т2. Константа диссоциации Н2 2,56*10-34(300 К), 1,22*10-3 (2000 К); энергия диссоциации Н2 436 кДж/моль; межъядерное расстояние 0,07414 нм; осн. частота колебаний атомов 4405,30 см -1, поправка на ангармоничность 125,32 см -1.
Содержание водорода в земной коре (литосфере и гидросфере) 1% по массе, или 16 ат.%, в атмосфере -10-4 ат.%. В природе водород распространен чаще всего в виде соед. с О, С, S, N и С1, реже - с Р, I, Вr и др. элементами; он входит в состав всех растительных и животных организмов, нефти, ископаемых углей, прир. газа, воды, ряда минералов и пород (в форме гидратов). В своб. состоянии на Земле встречается очень редко (в небольших кол-вах - в вулканич. газах и продуктах разложения орг. остатков). Водород - самый распространенный элемент Вселенной; в виде плазмы он составляет ок. половины массы Солнца и большинства звезд, осн. часть газа межзвездной среды и газовых туманностей.
Свойства. Водород - бесцв. газ без вкуса и запаха; плотность при 273,15 К и атм. давлении 0,0899 кг/м3 (0,0695 по отношению к воздуху); мольный объем 22,43 м3/кмоль. Коэф. сжимаемости (pv/RT)при 273,15 К: 1,0006 (0,1013 МПа), 1,0124 (2,0266 МПа), 1,0644 (10,133 МПа), 1,134 (20,266 МПа), 1,277 (40,532 МПа); С°р 14,235 кДж/(кг*К), С? 10,090 кДж/(кг*К); ур-ние температурной зависимости Сp° в интервале 298-3000 К: С° = 4,1868(6,52 + 0,78*10-3 Т+ + 0,12*105/Т2) Дж/(моль*К);  Нoсгор-143,06 МДж/кг; температурный коэф. объемного расширения 3658,8*10-1 К-1 в интервале 273-373 К;
Нoсгор-143,06 МДж/кг; температурный коэф. объемного расширения 3658,8*10-1 К-1 в интервале 273-373 К; 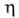 газа 0,88-10" 5 Па*с (293,15 К); показатель преломления газа п589,3 1,000132.
газа 0,88-10" 5 Па*с (293,15 К); показатель преломления газа п589,3 1,000132.
Водород быстрее др. газов распространяется в пространстве, проходит через мелкие поры, при высоких т-рах сравнительно легко проникает сквозь сталь и др. материалы.
Обладает высокой теплопроводностью, равной при 273,15 К и 1013 гПа 0,1717 Вт/(м*К) (7,3 по отношению к воздуху); ур-ние температурной зависимости теплопроводности: 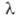 = 0,1591 (367/T + 94)(Т/273)3/2 Вт/(м*К).
= 0,1591 (367/T + 94)(Т/273)3/2 Вт/(м*К).
Р-римость водорода: в воде при 273,15 К и атм. давлении -0,0215% по объему; при 298,15 К и 10,133 МПа в воде - 1,73 см3/г, в метаноле - 11,0 см3/г. Водород хорошо раств. во мн. металлах, лучше всего в Pd (в одном объеме Pd раств. 850 объемов водорода). Губчатое железо при 0,1013 МПа и 973 К поглощает 0,14, а при 1173 К - 0,37 объемов водорода на 1 объем металла.
Водород может находиться в орто- и пара-состояниях. Ортоводород (о-Н2) имеет параллельную (одного знака) ориентацию ядерных спинов, параводород (п-Н2) - антипараллельную. Это обусловливает нек-рое различие магнитных, оптич. и термич. св-в указанных модификаций. При обычных и высоких т-рах Н2 (нормальный водород, н-Н2) представляет собой смесь 75% орто- и 25% пара-модификаций, к-рые могут взаимно превращаться друг в друга (орто-пара-превращение). Различают также равновесный водород (р-Н2), имеющий равновесный орто-пара-состав для данной т-ры (табл. 1). При превращ. о-Н2  п-Н2 выделяется тепло (1418 Дж/моль). Такое превращ. характерно и для др. изотопов водорода.
п-Н2 выделяется тепло (1418 Дж/моль). Такое превращ. характерно и для др. изотопов водорода.
Табл. 1.-СОСТАВ РАВНОВЕСНОГО ВОДОРОДА И ТЕПЛОТА ПРЕВРАЩЕНИЯ н-Н2->р-Н2

Самопроизвольное орто-пара-превращение водорода при низкой т-ре происходит очень медленно, что позволяет получать жидкий водород, близкий по орто-пара-составу к н-Н2, хотя термодинамически устойчив при этих условиях только п-Н2. Орто-пара-превращение ускоряется в присут. катализаторов (активного угля, оксидов и гидроксидов ряда металлов, в т. ч. РЗЭ, и др.). Нек-рые св-ва модификаций водорода приведены в табл. 2, св-ва жидкого водорода- в табл. 3.
Табл. 2-СВОЙСТВА МОДИФИКАЦИЙ ВОДОРОДА

Табл. 3.-СВОЙСТВА ЖИДКОГО ВОДОРОДА
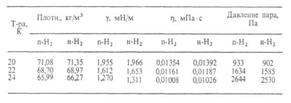
Теплоемкость жидкого водорода мало зависит от орто-пара-состава; ур-ние температурной зависимости: С? = 6,86 + + 0,66*10-4 T + 0,279*10-6 Т2 кДж/(кг*К); ур-ние температурной зависимости теплопроводности жидкого водорода под давлением паров (независимо от орто-пара-состава):  =1,16(1,70+ 0,0557Т)*10-4 Вт/(м*К); показатель преломления n435,9 1,1118 при 20,33 К.
=1,16(1,70+ 0,0557Т)*10-4 Вт/(м*К); показатель преломления n435,9 1,1118 при 20,33 К.
Ур-ние температурной зависимости давления пара над жидким и твердым водородом: lgO,0075p (Па) = А - В/Т + СТ (значения А, В и С приведены в табл. 4).
Табл. 4.-ЗНАЧЕНИЯ КОЭФФИЦИЕНТОВ А, В, С В УРАВНЕНИИ ТЕМПЕРАТУРНОЙ ЗАВИСИМОСТИ ДАВЛЕНИЯ ПАРА Н2

Твердый водород кристаллизуется в гексагон. решетке (а = = 0,378 нм, с = 0,6167 нм), в узлах к-рой расположены молекулы Н2, связанные между собой слабыми межмол. силами; плотн. 86,67 кг/м3; С° 4,618 Дж/(моль*К) при 13 К; диэлектрик. При давлении свыше 10000 МПа предполагается фазовый переход с образованием структуры, построенной из атомов и обладающей металлич. св-вами. Теоретически предсказана возможность сверхпроводимости "металлич. водорода".
Водород в обычном состоянии при низких т-рах мало активен, без нагревания реагирует лишь с F2 и на свету с С12. С неметаллами водород взаимод. активнее, чем с металлами. С кислородом реагирует практически необратимо, образуя воду с выделением 285,75 МДж/моль тепла; в присут. катализаторов (Pt, Pel, Ni) эта р-ция идет достаточно быстро при 80-130 °С. С азотом в присут. катализатора при повышенных т-рах и давлениях водород образует аммиак, с галогенами -галогеноводороды, с халькогенами - гидриды: H2S (выше 600 °С), H2Se (выше 530 °С) и Н2Те (выше 730 °С). С углеродом водород реагирует только при высоких т-рах, образуя углеводороды. Практич. значение имеют р-ции водорода с СО, при к-рых в зависимости от условий и катализатора образуются метанол или (и) др. соединения. Со щелочными и щел.-зем. металлами, элементами III, IV, V и VI гр. периодич. системы, а также с интерметаллич. соед. водород образует гидриды. Водород восстанавливает оксиды и галогениды мн. металлов до металлов, ненасыщ. углеводероды - до насыщенных (см. Гидрирование). Водород легко отдает свой электрон, в р-ре отрывается в виде протона от многих соед., обусловливая их кислотные св-ва. В водных р-рах Н+ образует с молекулой воды ион гидроксония Н3О. Входя в состав молекул различных соед., водород склонен образовывать со многими электроотрицат. элементами (F, О, N, С, В, Cl, S, Р) водородную связь.
Получение. Осн. виды сырья для пром. произ-ва водорода - прир. газ, жидкие и твердые горючие ископаемые, вода. наиб. кол-во водорода получают паровой конверсией прир. газа, включающей след. стадии.
1) Каталитич. конверсию газа с водяным паром:
СН4 + Н2О -> СО + ЗН2 - 206 кДж
Осуществляется в присут. Ni на А12О3 при 750-870 °С в трубчатых реакторах. Для наружного обогрева стальных трубок реактора часть прир. газа сжигают. По др. способу в смесь газа с водяным паром добавляют О2 (0,55 — 0,65 м3 на 1 м3 СН4), благодаря чему конверсия СН4 становится автотермичной (в результате экзотермич. р-ции: СН4 + 1/2О2-> СО + 2Н2 + 35,6 кДж) и не требует наружного обогрева реактора. Этот процесс осуществляют в реакторах шахтного типа при 830-1000°С.
2) Конверсию СО с водяным паром: СО + ЗН2 + Н2О -> СО2 + 4Н2 + 41 кДж; процесс проводят при 370-440 °С в присут. железохромового кат. (первая ступень) и при 230-260 °С в присут. цинкхроммедного кат. (вторая ступень).
3) Очистку газовой смеси от СО2 и остатков непрореагировавших СО, СН4 и Н2О осуществляют обычными методами (см. Газов очистка).
Известен также способ высокотемпературной (1350-1450 °С) конверсии газообразных углеводородов, основанный на их неполном окислении кислородом до СО в своб. объеме без катализатора. Дальнейшие стадии конверсии СО и очистки газовой смеси аналогичны применяемым в первом способе.
Получение водорода из твердых горючих ископаемых включает их переработку с водяным паром и воздухом или О2 (газификацию): С + Н2О -> СО + Н2 - 118,9 кДж; 2С + О2 -> 2СО + 230 кДж. В результате образуется водяной газ (содержащий до 40% СО и 50% Н2), а также СО2, СН4, N2 и примеси сернистых соединений. После очистки от последних получают водород, как указано в первом способе. Аналогично перерабатывают и тяжелые нефтяные остатки.
Газ, содержащий 85-90% водорода и 10-15% др. газов, гл. обр. углеводородов, получают в кач-ве побочного продукта на нефтеперерабатывающих заводах (см. Газы нефтепереработки). Из газа коксовых печей, содержащего 55-60% водорода, последний выделяют методом фракц. конденсации при глубоком охлаждении (см. Газов разделение).
Сравнительно небольшое кол-во водорода (и одновременно О2) получают электролизом воды. Электролитом служит водный р-р КОН (350-400 г/л); давление в электролизерах от атмосферного до 4 МПа, их производительность 4-500 м3/ч, расход электроэнергии 5,1-5,6 кВт*ч на 1 м3 водорода (теоретич. расход при 25 °С 2,94 кВт*ч). Разрабатываются высокотемпературные процессы электролита ч. разложения воды (с целью снижения расхода электроэнергии и уменьшения объема аппаратуры). значит. кол-ва водорода образуются в кач-ве побочного продукта при электролитич. произ-ве С12 и щелочей, хлоратов, Н2О2.
Перспективные методы получения водорода - термохим. и термоэлектрохим. циклы разложения воды с использованием тепла, выделяемого в атомных реакторах (см. Водородная энергетика). В этих циклах все компоненты системы, кроме воды, полностью регенерируются.
Производится также жидкий п-Н2. Для этого водород тщательно очищают от всех примесей, в т. ч. от О2 (до содержания менее 1*10-9 объемных долей), охлаждают жидким N2, сжижают путем дросселирования и расширения газа в детандере и осуществляют орто-пара-превращение водорода в присут. катализаторов. Расход энергии составляет 72-105 МДж на 1 кг жидкого водорода. Мощность установок по произ-ву жидкого водорода в США превышает 155 т/сут.
Атомарный водород образуется из молекулярного при термич. диссоциации, под действием электрич. разрядов, излучения с длиной волны менее 85 нм и при воздействии медленных электронов.
Определение. В составе газовых смесей водород определяют методами хроматографии, масс-спектрометрии, каталитич. сжиганием с послед. определением кол-ва образовавшейся воды, по уменьшению объема и тепловому эффекту, измерением теплопроводности газовой смеси.
Применение. Газообразный водород применяют для синтеза NH3, CH3OH, высших спиртов, углеводородов, НС1 и др., как восстановитель при получении мн. орг. соединений, в т.ч. пищ. жиров. В металлургии водород используют для получения металлов, создания защитной среды при обработке металлов и сплавов, в нефтепереработке - для гидроочистки нефтяных фракций и смазочных масел, гидрирования и гидрокрекинга нефтяных дистиллатов, нефтяных остатков и смол. Водород применяют также в произ-ве изделий из кварцевого стекла и др. с использованием водородно-кислородного пламени (т-ра выше 2000°С), для атомно-водородной сварки тугоплавких сталей и сплавов, для охлаждения турбогенераторов, как восстановитель в топливных элементах.
Жидкий водород применяется как горючее в ракетной и космич. технике, для заполнения пузырьковых камер, в кач-ве хладагента в криогенных конденсационных и адсорбционных вакуум-насосах.
В 1980 в США расход водорода составил (% к общему потреблению): на синтез NH3 - 26, синтез СН3ОН - 3,3, гидрокрекинг - 34,7, гидроочистку нефтепродуктов - 21, нефтехим. синтез - 3,5.
Водород нетоксичен, но пожаро- и взрывоопасен; т-ра взрывного самовоспламенения в воздухе 577 °С; КПВ в воздухе 4-75%, в О2-4,65-96% по объему. Жидкий водород при попадании на открытые участки тела может вызвать сильное обморожение. Газообразный водород хранят в мокрых и сухих газгольдерах, емкостях высокого давления и транспортируют по трубопроводам; малые кол-ва хранят и транспортируют в стальных баллонах под давл. до 20 МПа. Разрабатываются проекты подземного хранения больших кол-в водорода в выработанных месторождениях нефти и газа, горных выработках, искусств. соляных кавернах. Жидкий водород хранят и транспортируют в спец. герметич. резервуарах с эффективной тепловой изоляцией; сосуды емкостью от 15 до 75 л могут иметь экран из жидкого N2. Емкость автомобильных прицепов и полуприцепов 25-75 м3, железнодорожных цистерн 100-125 м3, стационарных хранилищ - до 3000 м3. Ведутся разработки в области техники получения и хранения водорода в твердом и шугообразном (до 50% твердой фазы) состоянии. Водород можно хранить и транспортировать в виде твердых гидридов металлов и интерметаллич. соед., способных поглощать и отдавать при нагр. неск. сотен объемов водорода на единицу своей массы. Мировое произ-во водорода свыше 30 млн. т/год (1980).
Водород был открыт в 1-й пол. 16 в. Парацельсом. В 1776 Г. Кавендиш впервые исследовал его св-ва, в 1783-1787 А. Лавуазье показал, что водород входит в состав воды, включил его в список хим. элементов и предложил название "гидроген".
ВОДА (оксид водорода) Н2О, мол. м. 18,016, простейшее устойчивое соед. водорода с кислородом. Жидкость без запаха, вкуса и цвета.
Распространение в природе. Вода - одно из самых распространенных на Земле соединений. Молекулы воды обнаружены в межзвездном пространстве. Вода входит в состав комет, большинства планет солнечной системы и их спутников. Кол-во воды на пов-сти Земли оценивается в 1,39*1018 т, большая часть ее содержится в морях и океанах. Кол-во доступных для использования пресных вод в реках, озерах, болотах и водохранилищах составляет 2*104 т. Масса ледников Антарктики, Антарктиды и высокогорных районов 2,4*1016т, примерно столько же имеется подземных вод, причем только небольшая их часть - пресные. В глубинных слоях Земли содержится значительно больше (повидимому, не менее, чем на порядок) воды, чем на пов-сти. В атмосфере находится ок. 1,3*1013 т воды. Вода входит в состав мн. минералов и горных пород (глины, гипс и др.), присутствует в почве, является обязат. компонентом всех живых организмов.
Изотопный состав. Существует 9 устойчивых изотопных разновидностей воды. Содержание их в пресной воде в среднем следующее (мол. %): 1Н216О - 99,13; 1Н218О - 0,2; 1Н2170-0,04; 1Н2О16О-0,03; остальные пять изотопных разновидностей присутствуют в воде в ничтожных кол-вах. Кроме стабильных изотопных разновидностей, в воде содержится небольшое кол-во радиоактивного 3Н2 (или Т2О). Изотопный состав природной воды разного происхождения неск. варьирует. Особенно непостоянно отношение 1Н/2Н: в пресных водах - в среднем 6900, в морской воде -5500, во льдах - 5500-9000. По физ. свойствам D2O заметно отличается от обычной воде (см. Тяжелая вода). Вода, содержащая 18О, по св-вам ближе к воде с 16О.
Строение молекулы и физические свойства. Атомы водорода и кислорода в молекуле воды расположены в углах равнобедренного треугольника с длиной связи О—Н 0,0957 нм; валентный угол Н—О—Н 104,5°; дипольный момент 6,17*10-30 Кл*м; поляризуемость молекулы 1,45*10-3 нм3; средний квадрупольный момент — 1,87*10-41 Кл*м2, энергия ионизации 12,6 эВ, сродство к протону 7,1 эВ. При взаимод. молекулы воды с др. атомами, молекулами и ионами, в т.ч. с другими молекулами воды в конденсир. фазах, эти параметры изменяются.
Нек-рые параметры, характеризующие св-ва воды в разных агрегатных состояниях при атм. давлении, приведены ниже (см. также табл. 1 и рис. 1, на к-ром указаны области существования разл. модификаций льда):

Физ. свойства воды аномальны. Плавление льда при атм. давлении сопровождается уменьшением объема на 9%. Температурный коэф. объемного расширения льда и жидкой воды отрицателен при т-pax соотв. ниже -210°С и 3,98 °С. Теплоемкость С° при плавлении возрастает почти вдвое и в интервале 0-100°С почти не зависит от т-ры (имеется минимум при 35 °С). Минимум изо-термич. сжимаемости (44,9*10-11 Па-1), наблюдаемый при 46°С, выражен довольно четко. При низких давлениях и т-рах до 30 °С вязкость воды с ростом давления падает. Высокие диэлектрич. проницаемость и диполъный момент воды определяют ее хорошую растворяющую способность по отношению к полярным и ионогенным в-вам. Благодаря высоким значениям С°,  и
и  вода-важный регулятор климатич. условий на земле, стабилизирующий т-ру на ее пов-сти. Кроме того, близость угла Н—О—Н к тетраэдрическому (109° 28') обусловливает рыхлость структур льда и жидкой воды и, как следствие, аномальную зависимость плотности от т-ры. Поэтому не промерзают до дна крупные водоемы, что делает возможным существование в них жизни.
вода-важный регулятор климатич. условий на земле, стабилизирующий т-ру на ее пов-сти. Кроме того, близость угла Н—О—Н к тетраэдрическому (109° 28') обусловливает рыхлость структур льда и жидкой воды и, как следствие, аномальную зависимость плотности от т-ры. Поэтому не промерзают до дна крупные водоемы, что делает возможным существование в них жизни.
Взаимодействие между молекулами воды. Структура конденсированных фаз. Молекулы воды, обладая значит. ди-польным моментом, сильно взаимод. друг с другом и полярными молекулами др. в-в. При этом атомы водорода могут образовывать водородные связи с атомами О, N, F, Cl, S и др. В водяном паре при невысоких т-рах и умеренных давлениях присутствует небольшое кол-во (ок. 1% при т-ре кипения и атм. давлении) димеров воды (для них ~ 15 кДж/моль), расстояние между атомами кислорода  ~ 0,3 нм. В конденсиров. фазах каждая молекула воды образует четыре водородные связи: две - как донор протонов и две - как акцептор протонов. Средняя длина этих связей в кристаллич. модификациях льда и кристаллогидратах ок. 0,28 нм. Угол О—Н...О стремится к 180°. Четыре водородные связи молекулы воды направлены приблизительно к вершинам правильного тетраэдра (рис. 2).
~ 0,3 нм. В конденсиров. фазах каждая молекула воды образует четыре водородные связи: две - как донор протонов и две - как акцептор протонов. Средняя длина этих связей в кристаллич. модификациях льда и кристаллогидратах ок. 0,28 нм. Угол О—Н...О стремится к 180°. Четыре водородные связи молекулы воды направлены приблизительно к вершинам правильного тетраэдра (рис. 2).
Структура модификаций льда представляет собой трехмерную сетку. В плотных модификациях VI-VIII, устойчивых при высоких давлениях, можно даже выделить две такие сетки, "вставленные" одна в другую. В модификациях, существующих при низких давлениях (льды Ih и Iс), связи Н—О—Н почти прямолинейны и направлены к вершинам практически правильного тетраэдра. В модификациях II-VI связи искривлены и углы между ними отличаются от тетраэдрического, что обусловливает увеличение плотности по сравнению с плотностью обычного льда.

Рис. 2. Схема тетраэдрич. координации молекулы воды; сплошные линии - ковалентные связи; пунктирные линии - водородные связи.
Но плотность модификаций II-VI значительно ниже той, к-рой мог бы обладать лёд при плотной упаковке молекул. Только в модификациях VII и VIII достигается достаточно высокая плотность упаковки: в их структуре две правильные сетки, построенные из тетраэдров (аналогичные существующим в кубич. низкотемпературном льде Iс, изоструктурном алмазу), вставлены одна в другую; при этом сохраняется система прямолинейных водородных связей, а координац. число по кислороду удваивается и достигает 8. Расположение атомов кислорода во льдах VII и VIII подобно расположению атомов в  железе и многих др. металлах. В обычном (Ih) и кубическом (Iс) льдах, а также во льдах HI, V-VII ориентация молекул не определена: оба ближайших к атому О протона образуют с ним ковалентные связи, к-рые м. б. направлены к любым двум из четырех соседних атомов кислорода в вершинах тетраэдра. Диэлектрич. проницаемость этих модификаций высока (выше, чем у жидкой воды). Модификации II, VIII и IX ориентационно упорядочены; их диэлектрич. проницаемость низка (ок. 3). Лед VIII представляет собой упорядоченный по размещению протонов вариант льда VII, а лед IX - льда III. Плотности ориентационно упорядоченных модификаций (VIII, IX) близки к плотностям соответствующих неупорядоченных (VII, III).
железе и многих др. металлах. В обычном (Ih) и кубическом (Iс) льдах, а также во льдах HI, V-VII ориентация молекул не определена: оба ближайших к атому О протона образуют с ним ковалентные связи, к-рые м. б. направлены к любым двум из четырех соседних атомов кислорода в вершинах тетраэдра. Диэлектрич. проницаемость этих модификаций высока (выше, чем у жидкой воды). Модификации II, VIII и IX ориентационно упорядочены; их диэлектрич. проницаемость низка (ок. 3). Лед VIII представляет собой упорядоченный по размещению протонов вариант льда VII, а лед IX - льда III. Плотности ориентационно упорядоченных модификаций (VIII, IX) близки к плотностям соответствующих неупорядоченных (VII, III).
Трехмерная сетка водородных связей, построенная из тетраэдров, существует и в жидкой воде во всем интервале от т-ры плавления до критической. Увеличение плотности при плавлении, как и в случае плотных модификаций льда, объясняется искривлением водородных связей и отклонением углов между ними от тетраэдрических. Искривление связей увеличивается с ростом т-ры и давления, что приводит к возрастанию плотности. С др. стороны, при нагр. средняя длина водородных связей становится больше, в результате чего плотность уменьшается. Совместное действие двух факторов объясняет наличие максимума плотности воды при 3,98 °С.
Химические свойства. Лишь незначит. доля молекул (при 25°С - примерно 1 на 5*109) подвергается электролитич. диссоциации по схеме: Н2О  Н+ + ОН-. Протон Н + в водной среде, взаимодействуя с молекулами воды, образует Н3О+, объединяющийся с 1 молекулой Н2О в H5O2+. Расстояние О...О в таких комплексах заметно короче длины нормальной водородной связи между нейтральными молекулами. Но поскольку протон, по-видимому, находится не точно посредине этой укороченной связи, а ближе к одному из атомов О, можно считать, что в воде существует гидратированный ион оксония Н3О+. Это явление играет большую роль в хим. процессах, происходящих в разл. системах, в т. ч. биологических. В частности, диссоциация воды - причина гидролиза солей слабых к-т и (или) оснований. Концентрация ионов Н+ и связанная с ней концентрация ионов ОН- -важные характеристики водных р-ров (см. Водородный показатель). Степень электролитич. диссоциации воды заметно возрастает при повышении т-ры.
Н+ + ОН-. Протон Н + в водной среде, взаимодействуя с молекулами воды, образует Н3О+, объединяющийся с 1 молекулой Н2О в H5O2+. Расстояние О...О в таких комплексах заметно короче длины нормальной водородной связи между нейтральными молекулами. Но поскольку протон, по-видимому, находится не точно посредине этой укороченной связи, а ближе к одному из атомов О, можно считать, что в воде существует гидратированный ион оксония Н3О+. Это явление играет большую роль в хим. процессах, происходящих в разл. системах, в т. ч. биологических. В частности, диссоциация воды - причина гидролиза солей слабых к-т и (или) оснований. Концентрация ионов Н+ и связанная с ней концентрация ионов ОН- -важные характеристики водных р-ров (см. Водородный показатель). Степень электролитич. диссоциации воды заметно возрастает при повышении т-ры.
Образование воды из элементов по р-ции Н2 + 1/2O2 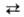 Н2O (
Н2O ( Hoобр -242 кДж/моль для пара и -286 кДж/моль для жидкой воде) при низких т-рах в отсутствие катализаторов происходит крайне медленно, но скорость р-ции резко возрастает при повышении т-ры, и при 550 °С она происходит со взрывом. При снижении давления и возрастании т-ры равновесие сдвигается влево. Степень термич. диссоциации воды (%) при 100 кПа: 0,034 (1015°С), 0,74 (1711 °С), 8,6 (2215°С) и 11,1 (2483°С). Под действием УФ-излучения происходит фотодиссоциация воды на ионы Н+ и ОН-. Ионизирующее излучение вызывает радиолиз воды с образованием Н2, Н2О2 и своб. радикалов
Hoобр -242 кДж/моль для пара и -286 кДж/моль для жидкой воде) при низких т-рах в отсутствие катализаторов происходит крайне медленно, но скорость р-ции резко возрастает при повышении т-ры, и при 550 °С она происходит со взрывом. При снижении давления и возрастании т-ры равновесие сдвигается влево. Степень термич. диссоциации воды (%) при 100 кПа: 0,034 (1015°С), 0,74 (1711 °С), 8,6 (2215°С) и 11,1 (2483°С). Под действием УФ-излучения происходит фотодиссоциация воды на ионы Н+ и ОН-. Ионизирующее излучение вызывает радиолиз воды с образованием Н2, Н2О2 и своб. радикалов 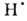
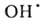
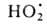 ; радиац. выход - примерно 4 распавшиеся молекулы на каждые 1,6*10-17 Дж поглощенной энергии излучения.
; радиац. выход - примерно 4 распавшиеся молекулы на каждые 1,6*10-17 Дж поглощенной энергии излучения.
Вода - реакционноспособное соединение. Она окисляется атомарным кислородом: Н2О + О -> Н2О2. При взаимод. воды с F2 образуются HF, а также О, О2, О3, Н2О2, F2O и др. соединения. С остальными галогенами при низких т-рах вода реагирует с образованием смеси к-т HHal и ННаlO. При обычных условиях с водой взаимод. до половины растворенного в ней С12 и значительно меньшие кол-ва Вr2 и 12. При повыш. т-рах хлор и бром разлагают воду с образованием HHal и О2. При пропускании паров воды через раскаленный уголь она разлагается и образуется т. наз. водяной газ: Н2О + С  СО + Н2. При повыш. т-ре в присут. катализатора вода реагирует с СО, СН4 и др. углеводородами, напр.: Н2О + СО
СО + Н2. При повыш. т-ре в присут. катализатора вода реагирует с СО, СН4 и др. углеводородами, напр.: Н2О + СО  СО2 + Н2 (кат. Fe); Н2О + СН4
СО2 + Н2 (кат. Fe); Н2О + СН4  СО + ЗН2 (кат. Ni или Со). Эти р-ции используют для пром. получения Н2. Перспективны для его произ-ва также термохим. способы разложения воды (см. Водород, Водородная энергетика). Фосфор при нагр. с водой под давлением в присут. катализатора окисляется в метафосфорную к-ту: 6Н2О + ЗР -> 2НРО3 + 5Н2. Вода взаимод. со мн. металлами с образованием Н2 и соответствующего гидроксида. Со щелочными и щел.-зем. металлами (кроме Mg) эта р-ция протекает уже при комнатной т-ре. Менее активные металлы разлагают воду при повыш. т-ре, напр. Mg и Zn-выше 100°С, Fe - выше 600°С (2Fe + ЗН2О -> Fe2O3 + 3H2). При взаимод. с воды многих оксидов образуются к-ты или основания. Вода может служить катализатором, напр. щелочные металлы и водород реагируют с хлором только в присут. следов воды Иногда вода - каталитич. яд, напр. для железного катализатора при синтезе NH3.
СО + ЗН2 (кат. Ni или Со). Эти р-ции используют для пром. получения Н2. Перспективны для его произ-ва также термохим. способы разложения воды (см. Водород, Водородная энергетика). Фосфор при нагр. с водой под давлением в присут. катализатора окисляется в метафосфорную к-ту: 6Н2О + ЗР -> 2НРО3 + 5Н2. Вода взаимод. со мн. металлами с образованием Н2 и соответствующего гидроксида. Со щелочными и щел.-зем. металлами (кроме Mg) эта р-ция протекает уже при комнатной т-ре. Менее активные металлы разлагают воду при повыш. т-ре, напр. Mg и Zn-выше 100°С, Fe - выше 600°С (2Fe + ЗН2О -> Fe2O3 + 3H2). При взаимод. с воды многих оксидов образуются к-ты или основания. Вода может служить катализатором, напр. щелочные металлы и водород реагируют с хлором только в присут. следов воды Иногда вода - каталитич. яд, напр. для железного катализатора при синтезе NH3.
Способность молекул воды образовывать трехмерные сетки водородных связей позволяет ей давать с инертными газами, углеводородами, СО2, С12, (СН2)2О, СНС13 и многими др. в-вами т. наз. газовые гидраты.
Вода как растворитель. Вода хорошо растворяет мн. полярные и диссоциирующие на ионы в-ва. Обычно р-римость возрастает с увеличением т-ры, но иногда температурная зависимость имеет более сложный характер. Так, р-римость мн. сульфатов, карбонатов и фосфатов при повышении т-ры уменьшается или сначала повышается, а затем проходит через максимум. Р-римость малополярных в-в (в т. ч. газов, входящих в состав атмосферы) в воде низкая и при повышении т-ры обычно сначала снижается, а затем проходит через минимум. С ростом давления р-римость газов возрастает, проходя при высоких давлениях через максимум. Многие в-ва, растворяясь в воде, реагируют с ней. Напр., в р-рах NH3 могут присутствовать ионы NH4 (см. также Гидролиз). Между растворенными в воде ионами, атомами, молекулами, не вступающими с ней в хим. р-ции, и молекулами воды существуют не разрушающие их ион-дипольные и межмол. взаимодействия (см. Гидратация).
Природная вода. Представляет собой сложную многокомпонентную систему, в состав к-рой входят минер. в-ва, газы, а также коллоидные и крупнодисперсные частицы, в т. ч. микроорганизмы. По величине минерализации (г/л) различают след. природные воды: ультрапресные - до 0,2, пресные - 0,2-0,5, слабоминерализованные - 0,5-1,0, солоноватые - 1-3, соленые - 3-10, с повыш. соленостью - 10-35, переходные к рассолам - 35-50, рассолы - более 50. Макрокомпонентами природной воды обычно являются Са, Mg, Na, К, Fe (катионогенные воды), Si, С, S, C1 (анионогенные воды). К микрокомпонентам природной воды относятся редкие и рудные элементы, напр. В, Li, Rb, Cu, Zn, Bi, Be, W, U, Br, I и др.
Осн. газы, содержащиеся в прир. воде, - СО2, N2 (характерны как для поверхностных, так и для глубинных условий), СН4, СО, Н2 (более типичны для подземных водах и для воды вулканич. активных областей). Растворенные в воде компоненты находятся в равновесии, образуя комплексы разл. состава. Данные о составе нек-рых природной воды приведены в табл. 2.
Табл. 2-СОСТАВ ПРИРОДНЫХ ВОД
Питьевая вода. Общее число микроорганизмов в 1 мл питьевой воды должно быть не выше 100, число бактерий группы кишечных палочек (коли-индекс) - не более 3. Концентрация хим. в-в, к-рые встречаются в природной воде или добавляются к воде при ее обработке (см. Водоподготовка), не должна превышать (мг/л):

Содержание примесей, к-рые влияют на органолептические св-ва воды и встречаются в природной воде или добавляются к воде при ее обработке, не должно превышать (мг/л):

Общая жесткость питьевой воды должна быть не выше 7,0 ммоль/л, сухой остаток - 1000 мг/л, рН - от 6,0 до 9,0. Для питьевой воды, подаваемой без спец. обработки, по согласованию с органами санитарно-эпидемиологич. службы допускаются след. показатели: сухой остаток - до 1500 мг/л, общая жесткость - до 10 ммоль/л, содержание железа и марганца - соотв. до 1 и до 0,5 мг/л.
Техническая вода. Воду, расходуемую пром. предприятиями, принято наз. технической. Ее применяют гл. обр. в кач-ве охлаждающего агента, транспортирующей среды для сыпучих материалов (напр., гидротранспорт золы на тепловых электростанциях), р-рителя и др. В целом по всем отраслям пром-сти 70-75% от общего расхода воды применяют как хладагент по циркуляц. схеме. В этом случае вода лишь нагревается и практически не загрязняется. Главные источники загрязнения охлаждающей воды систем циркуляц. водоснабжения - вода, добавляемая в системы для восполнения неизбежных потерь, и атм. воздух, из к-poro вымываются в охладителях воды взвешенные в-ва и газы, р-римые в воде.
Осн. ионами, к-рые могут приводить к отложениям минер, солей в системах циркуляц. водоснабжения, являются анионы НСО3-, CO32-, ОН-, SOl42-, PO43-, SiO32-, а также катионы Са2+, Mg2+, Fe2+,3+, A13+, Zn2+. Наиб. часто встречающийся компонент солевых отложений - СаСО3 (см. Жесткость воды). Предотвратить отложение карбонатов можно подкислением воды H2SO4 или НС1, ее рекарбонизацией (обычно обработка топочными газами, содержащими СО2), действием полифосфатов (NaPO3)6 и Na5P3O10, орг. фосфатов и др. Для предотвращения (уменьшения) коррозии труб и теплообменного оборудования в воде добавляют ингибиторы коррозии: полифосфаты, ингибиторы на основе хромато-цинковых смесей и др. Для предупреждения обрастания оборудования бактериями воды в основном хлорируют (содержание С12 до 5 мг/л), а иногда озонируют.
Лечебные воды. В кач-ве лечебных применяют природной воде, содержащие значит. кол-во минер, солей, газы, нек-рые элементы и др. (подробнее см. Минеральные воды).
Строение воды.
В 1772 г. французский химик А.Лавуазье (1743-1794) разработал большую программу экспериментальных исследований с целью определения состава воздуха, а чуть позже - состава воды. В результате многолетних исследований ему удалось доказать, что и воздух, и вода являются сложными веществами: в состав воздуха, кроме кислорода, входит газ, не поддерживающий горения, вода состоит из кислорода и водорода. Воду он разлагал при высокой температуре с помощью железных опилок и получал водород. Водород, соединяясь с кислородом, снова давал воду. А.Лавуазье говорил, что только "вещества, которые мы еще не смогли никаким образом разложить, являются для нас элементами".
Все свойства воды обусловлены наличием двух неподеленных электронных пар у атома кислорода, атомные орбитали которого гибридизированы по sp3-типу, и способностью атомов водорода соседних молекул образовывать с этими неподеленными электронными парами достаточно прочные водородные связи. В результате как жидкая, так и кристаллическая вода (лед) оказываются хорошо структурированными, хотя число локальных нарушений дальнего порядка при плавлении возрастает.
Экспериментально установлено, что протон в воде может быть только гидратированным. Гидратация не исчерпывается реакцией H+ + H2O = H3O+. Последовательно может присоединиться несколько молекул воды:

|
ВОДОРОДНАЯ СВЯЗЬ, вид химической связи типа А Н...А; образуется в результате взаимодействия атома водорода, связанного ковалентной связью с электроотрицательным атомом А (N, O, S и др.), и неподеленной парой электронов другого атома А (обычно O, N). Атомы А и А могут принадлежать как одной, так и разным молекулам. Водородная связь приводит к ассоциации одинаковых или различных молекул в комплексы; во многом определяет свойства воды и льда, молекулярных кристаллов, структуру и свойства многих синтетических полиамидов, белков, нуклеиновых кислот и др.
Свойства воды
Вода — оксид водорода — одно из наиболее распространенных и важных веществ. Поверхность Земли, занятая водой, в 2,5 раза больше поверхности суши. Чистой воды в природе нет, — она всегда содержит примеси. Получают чистую воду методом перегонки. Перегнанная вода называется дистиллированной. Состав воды (по массе): 11,19 % водорода и 88,81 % кислорода.
Чистая вода прозрачна, не имеет запаха и вкуса. Наибольшую плотность она имеет при 0° С (1 г/см3). Плотность льда меньше плотности жидкой воды, поэтому лед всплывает на поверхность. Вода замерзает при 0° С и кипит при 100° С при давлении 101 325 Па. Она плохо проводит теплоту и очень плохо проводит электричество. Вода — хороший растворитель. Молекула воды имеет угловую форму атомы водорода по отношению к кислороду образуют угол, равный 104,5°. Поэтому молекула воды — диполь: та часть молекулы, где находится водород, заряжена положительно, а часть, где находится кислород, — отрицательно. Благодаря полярности молекул воды электролиты в ней диссоциируют на ионы.
В жидкой воде наряду с обычными молекулами Н20 содержатся ассоциированные молекулы, т. е. соединенные в более сложные агрегаты (Н2О)x благодаря образованию водородных связей. Наличием водородных связей между молекулами воды объясняются аномалии ее физических свойств: максимальная плотность при 4° С, высокая температура кипения (в ряду Н20—Н2S — Н2Sе) аномально высокая теплоемкость [4,18 кДж/(г • К)]. С повышением температуры водородные связи разрываются, и полный разрыв наступает при переходе воды в пар.
Вода — весьма реакционноспособное вещество. При обычных условиях она взаимодействует со многими основными и кислотными оксидами, а также со щелочными и щелочно-земельными металлами. Вода образует многочисленные соединения - кристаллогидраты.
Очевидно, соединения, связывающие воду, могут служить в качестве осушителей. Из других осушающих веществ можно указать Р205, СаО, ВаО, металлический Ма (они тоже химически взаимодействуют с водой), а также силикагель. К важным химическим свойствам воды относится ее способность вступать в реакции гидролитического разложения.
Билет 36.
 2018-01-21
2018-01-21 1511
1511
