1. Запишем уравнения реакций растворения цинка в азотной кислоте с образованием отдельно NO2 и NO:
Zn + 4HNO3 → Zn(NO3)2 + 2NO2 + 2H2O;
3Zn + 8HNO3 → 3Zn(NO3)2 + 2NO + 4H2O.
Для того, чтобы получить мольное соотношение NO2: NO = 1: 3, надо второе уравнение умножить на 3 и сложить с первым:
10Zn + 28HNO3 → 10Zn(NO3)2 + 2NO2 + 6NO + 14H2O.
Соотношение n(HNO3): n(Zn) = 28: 10 = 2.8: 1.
Ответ: 2.8 моль HNO3.
2. 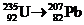 .
.
Пусть серия распадов включает x альфа- и y бета-распадов. Массовое число меняется только за счет альфа-распадов:
235 – 4 x = 207;
x = 7.
Заряд ядра меняется как за счет альфа-, так и за счет бета-распадов:
92 – 2 x + y = 82;
y = 4.
Ответ: 7 a-распадов, 4 b-распада.
3. Общая формула гомологического ряда предельных одноосновных карбоновых кислот C n H2 n O2. В молекуле кислоты содержится n + 2 n + 2 = 3 n + 2 атомов.
n(C n H2 n O2) = m / M = 97.5 / (14 n + 32) моль.
n(атомов) = (3 n + 2) · 97.5 / (14 n + 32) = 13.0 моль,
откуда n = 2. Следовательно, формула кислоты – C2H4O2.
Ответ: C2H4O2.
4. Число вторичных атомов углерода (CH2 групп) не влияет на число четвертичных, т.к. CH2 совпадает с гомологической разностью. Пусть в молекуле алкана C n H2 n +2 содержится x групп CH3, y групп CH и z четвертичных атомов C, тогда:
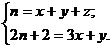
Умножая первую строчку на 2 и вычитая вторую строчку, находим: z = 0.5(x – y) – 1.
Ответ: Число четвертичных атомов углерода: 0.5(x – y) – 1.
5. Смешаем по одному литру растворов NaOH и HBr.
NaOH + HBr → NaBr + H2O.
До реакции: n(NaOH) = 0.04 моль, n(HBr) = 0.02 моль.
После реакции: n(NaOH) = 0.04 – 0.02 = 0.02 моль. Объем раствора после реакции – 2 литра. Молярная концентрация щелочи: c (NaOH) = 0.02 / 2 = 0.01 моль/л.
NaOH ® Na+ + OH–.
[OH–] = 0.01 моль/л, поскольку [H+][OH–] = 10–14, то
[H+] = 10–14 / 0.01 = 10–12 моль/л,
pH = –lg(10–12) = 12.
Ответ: pH = 12.
6. MF + H2SO4(конц) ® MHSO4 + HF;
2HF + Ca(OH)2 → CaF2¯ + 2H2O.
n(CaF2) = 27.3 / 78 = 0.35 моль;
n(MF) = n(HF) = 0.35 · 2 = 0.7 моль;
M (MF) = 18.2 / 0.7 = 26 г/моль;
A (M) = 26 – 19 = 7 г/моль. Неизвестный металл – литий.
Ответ: литий.
7. C n H2 n –6 ® C n H2 n –8 + H2;
C n H2 n –8 + Br2 ® C n H2 n –8Br2.
n(C n H2 n –8) = n(Br2) = 76 / 160 = 0.475 моль.
В первой реакции: n(C n H2 n –6) = nтеор(C n H2 n –8) = 0.475 / 0.6 = 0.792 моль.
M (C n H2 n –6) = 95 / 0.792 = 120 г/моль. Формула исходного углеводорода – C9H12.
Из восьми гомологов бензола состава C9H12 отщеплять водород с образованием двойной связи могут только те, у которых в боковой цепи есть хотя бы два атома углерода. Таких изомеров пять:

Ответ: Пять изомеров.
8. H2 + I2 ⇄ 2HI.
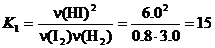 .
.
Пусть при охлаждении образовалось еще x моль HI, тогда израсходовано по 0.5 x моль H2 и I2:
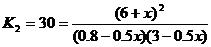 ;
;
x = 0.55,
n(HI) = 6 + x = 6.55 моль,
n(H2) = 3.0 – 0.5 x = 2.73 моль,
n(I2) = 0.8 – 0.5 x = 0.53 моль.
Ответ: 6.55 моль HI, 2.73 моль H2, 0.53 моль I2.
9. Найдем эмпирическую формулу комплекса:
n(Pt): n(N): n(Br): n(H) = (50.13/195): (7.20/14): (41.13/80): (1.54/1) = 1: 2: 2: 6.
Формула комплекса – PtN2Br2H6, или [Pt(NH3)2Br2]. Валентность Pt – IV. Получение:
PtBr2 + 2NH3 → [Pt(NH3)2Br2].
Комплекс имеет форму плоского четырехугольника с атомом платины в центре. Одинаковые лиганды могут находиться либо на одной стороне, либо на диагонали.
Геометрические изомеры:

Ответ: [Pt(NH3)2Br2]. Валентность центрального атома IV.
10. Исходное вещество C7H9N – любой из трех этилпиридинов (орто-, мета- или пара-).
1) Этилпиридин нитруется под действием азотной кислоты:
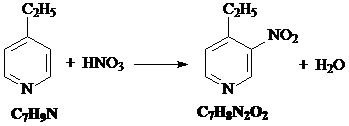
2) При взаимодействии этилпиридина с водным раствором перманганата калия этильная группа окисляется:

3) При прокаливании соли карбоновой кислоты с гидроксидом калия происходит декарбоксилирование:

4) Нитрогруппа восстанавливается до аминогруппы алюминием в щелочной среде:
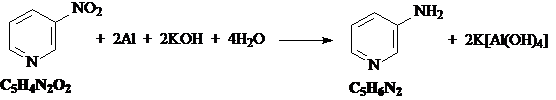
5) Исходное соединение – этилпиридин – можно прогидрировать водородом на никелевом катализаторе:
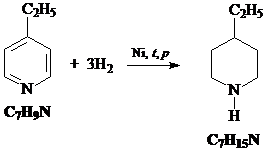
6) Полученный циклический амин присоединяет хлороводород:
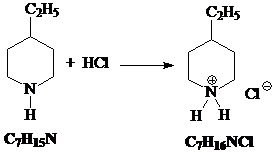
11. В обоих случаях происходит реакция нейтрализации:
H+ + OH– → H2O.
В первом случае в реакцию вступило по 0.01 · 0.50 = 5.0·10–3 моль ионов H+ и OH– и образовалось столько же моль H2O (на 20 мл раствора). Во втором случае ионы OH– находятся в недостатке: в реакцию вступило по 0.005 · 0.50 = 2.5 · 10–3 моль ионов H+ и OH– и образовалось столько же моль H2O, т.е. в 2 раза меньше, чем в первом случае. В результате реакции выделилось в 2 раза меньше теплоты, но эта теплота приходится на меньший объем раствора: 15 мл вместо 20. Понижение температуры во втором случае:
D T 2 = 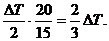
Ответ: (2/3)D T.
12. 1) При смешивании растворов хлорида железа (III) и силиката натрия происходит полный гидролиз обоих соединений. Если реакцию проводить при легком нагревании, то образуется не кремниевая кислота, а ее ангидрид:
2FeCl3 + 3Na2SiO3 + 3H2O → 2Fe(OH)3¯ + 3SiO2¯ + 6NaCl.
2) Гидроксид железа (III) при прокаливании теряет воду:
2Fe(OH)3 → Fe2O3 + 3H2O.
3) Оксид железа (III) восстанавливается до металла под действием углерода:
2Fe2O3 + 3C → 4Fe + 3CO2.
4) Углерод также восстанавливает оксид кремния:
SiO2 + C → Si + CO2.
5) Кремний растворяется в щелочах:
Si + 2NaOH + H2O → Na2SiO3 + 2H2.
6) При действии соляной кислоты на раствор силиката натрия образуется кремниевая кислота, которая при легком нагревании переходит в кремниевый ангидрид:
Na2SiO3 + 2HCl → SiO2¯ + 2NaCl + H2O.
Ответ: X1 – Fe(OH)3, X2 – Fe2O3, X3 – C, Y1 – SiO2, Y2 – Si, Y3 – Na2SiO3.
13. В реакциях с водой образуются два газа – водород и аммиак:
BaH2 + 2H2O → Ba(OH)2 + 2H2,
Li3N + 3H2O → 3LiOH + NH3.
При растворении смеси в соляной кислоте выделяется только водород:
BaH2 + 2HCl → BaCl2 + 2H2,
Li3N + 4HCl → 3LiCl + NH4Cl.
Пусть n(BaH2) = x моль, n(Li3N) = y моль, тогда n1(H2,NH3) = 2 x + y, n2(H2) = 2 x.
По условию: 2 x + y = 1.5 × 2 x, откуда x = y.
Исходная смесь – эквимолярная. Массовая доля гидрида бария:
w(BaH2) = M (BaH2) / (M (BaH2) + M (Li3N)) = 139 / (139 + 35) = 0.80 или 80%.
Ответ: 80%.
14. CO + Cl2 → COCl2.
Концентрация фосгена через 5 минут после начала реакции:
c (COCl2) = 5×2.5×10–3 = 1.25×10–2 моль/л.
Парциальное давление фосгена: p = cRT = 1.25×10–2 × 8.314 × 398 = 41.4 кПа.
Общее давление через 5 минут складывается из давления фосгена и давлений CO и Cl2, которые равны друг другу, так как в исходной смеси n(CO) = n(Cl2).
p = p (COCl2) + p (CO) + p (Cl2) = p (COCl2) + 2 p (Cl2).
p (Cl2) = (p – p (COCl2)) / 2 = (230 – 41.4) / 2 = 94.3 кПа.
В процессе реакции количество прореагировавшего хлора равно количеству образовавшегося фосгена, поэтому уменьшение давления хлора равно давлению фосгена:
p 0(Cl2) – p (Cl2) = p (COCl2),
p 0(Cl2) = p (Cl2) + p (COCl2) = 94.3 + 41.4 = 135.7 кПа.
Ответ: 135.7 кПа.
15. Уравнения процессов электролиза нитратов висмута и ртути:
Bi3+ + 3 e ® Bi 4
2H2O – 4 e ® O2 + 4H+ 3
4Bi(NO3)3 + 6H2O →4Bi¯ + 3O2 + 12HNO3;
Hg2+ + 2 e ® Hg 2
2H2O – 4 e ® O2 + 4H+ 1
2Hg(NO3)2 + 2H2O → 2Hg¯ + O2 + 4HNO3.
Пусть n(Bi(NO3)3) = x моль, а n(Hg(NO3)2) = y моль. Тогда n(Bi) = x моль, а n(Hg) = y моль.
Из условия задачи следует:
209 x + 201 y = 7.195.
Количество электронов, прошедших через раствор:
n(e) = It / F = 0.90×161×60 / 96500 = 0.09 моль.
Из уравнений восстановления ионов металлов следует:
3 x + 2 y = 0.09.
Решая систему двух уравнений, находим: x = 0.02, y = 0.015.
Молярные концентрации солей:
с (Bi(NO3)3) = 0.02 / 0.16 = 0.125 M,
с (Hg(NO3)2) = 0.015 / 0.16 = 0.094 M.
Ответ: 0.125 М Bi(NO3)3, 0.094 М Hg(NO3)2.
16. Для реакции с диэфиром потребовалось 30 – 6 = 24 мл 1.00 М раствора NaOH, т.е. 0.024 моль. Уравнение щелочного гидролиза:
ROOC-X-COOR + 2NaOH ® NaOOC-X-COONa + 2ROH.
Количество диэфира n = 0.024 / 2 = 0.012 моль.
Молярная масса диэфира: M (A) = 2.81 / 0.012 = 234.16» 234 г/моль.
Судя по продуктам гидролиза, диэфир содержит сложноэфирную группу COOCH3, другую сложноэфирную группу COOR, содержащую бензольное кольцо, и двойную связь CH=CH. С учетом оптической активности спирта C, который образуется при гидролизе, единственно возможная формула диэфира A:
H3COCOCH=CHCOOCH(CH3)C6H5
(брутто-формула C13H14O4). При гидролизе образуются CH3OH, дикарбоновая кислота
HOOC–CH=CH–COOH
и 1-фенилэтанол
C6H5–CH(OH)–CH3
(вещество C).
Непредельная кислота B при дегидратации образует циклический ангидрид, следовательно, вещество B – это цис -изомер:
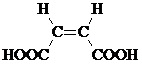
Структурная формула D:
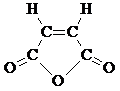
17. Запишем суммарное уравнение образования смеси метана, этана и пропана в молярном соотношении 3: 2: 2.
13CO + 33H2 ® 3CH4 + 2C2H6 + 2C3H8 + 13H2O.
Пусть в исходной смеси был 1 моль CO и 2 моль H2. В реакцию вступил 0.1 моль CO. Количества газов в смеси после реакции:
n(CO) = 1 – 0.1 = 0.9 моль,
n(H2) = 2 – 0.1×(33/13) = 1.75 моль,
n(CH4) = 0.1×(3/13) = 0.023 моль,
n(C2H6) = n(C3H8) = 0.1×(2/13) = 0.015 моль,
n(H2O) = nпрореаг(CO) = 0.1 моль.
До реакции в смеси было 3 моль газов, а после реакции:
0.9 + 1.75 + 0.023 + 2×0.015 + 0.1 = 2.80 моль.
Общее давление уменьшилось в 3 / 2.8 = 1.07 раза.
Ответ: Давление в системе уменьшилось в 1.07 раза.
18. Предположим для простоты, что аминокислоты, образующие дипептид, содержат только по одной аминогруппе. При кислотном гидролизе дипептида образуются хлороводородные соли аминокислот:
дипептид + 2HCl + H2O ® ClH3NCH(R)COOH + ClH3NCH(R’)COOH.
По массовой доле хлора можно найти молярную массу одной из этих солей:
M (ClH3NCH(R)COOH) = 35.5 / 0.2829 = 125.5 г/моль,
откуда M (R) = 15 г/моль, R – это метил CH3.
Одна из аминокислот – аланин.
С разбавленной соляной кислотой пептид образует соль:
дипептид + HCl ® дипептид×HCl.
Молярную массу соли также находим по содержанию хлора:
M (дипептид×HCl) = 35.5 / 0.1671 = 212.5 г/моль, откуда M (дипептида) = 176 г/моль. Дипептид состоит из остатков двух аминокислот, одна из которых – аланин (M = 89 г/моль):
аланин + аминокислота → дипептид + H2O,
M (аминокисл.) = 176 + 18 – 89 = 105 г/моль.
Такую молярную массу имеет серин (R’ – это CH2OH). Искомый дипептид – Ala-Ser или Ser-Ala:

Ответ: Ala-Ser или Ser-Ala.
Решение варианта О-2004-1
1. HCOOC2H5 + NaOH → HCOONa + C2H5OH.
2. М (С6Н6) = 78 г/моль. Составим пропорцию:
0.879 г – 1 см3
78 г – х
х = 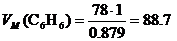 см3/моль.
см3/моль.
Ответ: 88.7 см3/моль.
3. Na2O + H2O ® 2Na+ + 2OH– щелочная среда;
CO2 + H2O ⇄ H+ + HCO3– кислотная среда;
CO32– + H2O ⇄ HCO3– + OH– щелочная среда;
K2SO4 ® 2K+ + SO42– нейтральная среда.
4. Формула гомологического ряда алифатических одноосновных карбоновых кислот
С n H2 n +1СООН. Массовая доля кислорода:
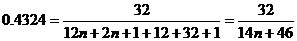 ,
,
n = 2, формула кислоты – С2Н5СООН.
Ответ: пропионовая кислота С2Н5СООН.
5. С2Н3СООН ⇄ С2Н3СОО– + Н+.
[H+] = 10–pH = 1.26 · 10–3;
a = [H+] / C = 0.0420, или 4.20%.
Ответ: 4.20%.
6. Обозначим n(H2) = x, а n(Cl2) = y моль. Можно составить систему уравнений:
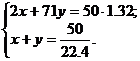
Решив систему, получим x = 1.34, y = 0.89. Таким образом, Cl2 – в недостатке.
n(HCl) = 2 · 0.89 = 1.78;
Q = 1.78 · 92 = 164 кДж.
Ответ: 164 кДж.
7. 1) AlCl3 + 3NH3 + 3H2O → Al(OH)3¯ + 3NH4Cl;
2) Al(OH)3 + 3HNO3 → Al(NO3)3 + 3H2O;
t°
3) 4Al(NO3)3 → 2Al2O3 + 12NO2↑ + 3O2↑;
↯
4) 2Al2O3 → 4Al + 3O2↑;
5) 2Al + 6HBr → 2AlBr3 + 3H2↑;
6) AlBr3 + 4KOH → K[Al(OH)4] + 3KBr.
Ответ: X – Al(OH)3, Y – Al2O3, Z – AlBr3.
8. H2O
1) CH3–CH2–CH2Br + NaOH → CH3–CH2–CH2–OH + NaBr;
250°C
2) CH3–CH2–CH2–OH + CuO → CH3–CH2–COH + Cu + H2O;
t °
3) CH3–CH2–COH + 2Cu(OH)2 → CH3–CH2–COOH + Cu2O + 2H2O;
Pкр.
4) CH3–CH2–COOH + Cl2 → CH3–CHCl–COOH + HCl;
5) CH3–CHCl–COOH + 2NH3 → CH3–CH(NH2)–COOH + NH4Cl;
H+
6) CH3–CH(NH2)–COOH + CH3OH → CH3–CH(NH2)–COOCH3 + H2O.
9. Гидроксид меди осаждается щелочью, а c аммиаком медь (II) дает комплексное соединение. Гидроксид алюминия осаждается раствором аммиака, а в избытке щелочи образует растворимый тетрагидроксоалюминат.
Первая порция раствора:
CuSO4 + 2KOH → Cu(OH)2¯ + K2SO4;
Al2(SO4)3 + 8KOH → 2K[Al(OH)4] + 3K2SO4;
t°
Cu(OH)2 → CuO + H2O.
n(CuO) = 1.40 / 80 = 0.0175 = n(CuSO4);
c (CuSO4) = 0.0175 / 0.05 = 0.35 М.
Вторая порция раствора:
Al2(SO4)3 + 6NH3 + 6H2O → 2Al(OH)3¯ + 3(NH4)2SO4;
CuSO4 + 4NH3 → [Cu(NH3)4]SO4;
t°
2Al(OH)3 → Al2O3 + 3H2O.
n(Al2O3) = 0.765 / 102 = 0.0075 = n(Al2(SO4)3);
c (Al2(SO4)3) = 0.0075 / 0.05 = 0.15 М.
Ответ: 0.35 М CuSO4, 0.15 M Al2(SO4)3.
10. Первый осадок – это солянокислая соль, образованная анилином:
n(C6H5–NH2) = n(C6H5–NH3Cl) = 38.85 / 129.5 = 0.3 моль;
m (C6H5–NH2) = 0.3 × 93 = 27.9 г;
w(C6H5–NH2) = 27.9%.
Осадок с бромной водой дает метилфенол:
n(CH3–C6H4–OH) = n (CH3–C6H2Br2–OH) = 53.2 / 266 = 0.2 моль;
m (CH3–C6H4–OH) = 0.2 × 108 = 21.6 г;
w(CH3–C6H4–OH) = 21.6%.
Количество бензола определяем по разности:
m (C6H6) = 100 – 27.9 – 21.6 = 50.5 г;
w(C6H6) = 50.5%.
Ответ: w(анилина) = 27.9%, w(метилфенола) = 21.6%, w(бензола) = 50.5%.
Решение варианта О-2004-2
1. H+
СH3COOCH3 + Н2O ⇄ СH3COOН + CH3OH.
2. М (С6Н14) = 86 г/моль. Составим пропорцию:
0.660 г –– 1 см3;
86 г –– х.
х = 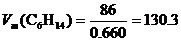 см3/моль.
см3/моль.
Ответ: 130.3 см3/моль.
3. CaO + H2O ® Ca2+ + 2OH– щелочная среда;
SO2 + H2O ⇄ H+ + HSO3– кислотная среда;
CH3COO– + H2O ⇄ CH3COOH + OH– щелочная среда;
NaNO3 ® Na+ + NO3– нейтральная среда.
4. Формула гомологического ряда монохлоралканов С n H2 n +1Сl, массовая доля хлора: 0. 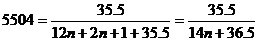 ,
,
n = 2, формула искомого монохлоралкана – С2Н5Cl.
Ответ: С2Н5Cl.
5. С6Н5СООН ⇄ С6Н5СОО– + Н+;
[H+] = 10–pH = 1.23 · 10–3;
a = [H+] / c = 0.0492 или 4.92%.
Ответ: 4.92%.
6. Пусть n(H2) = x, n(Cl2) = y моль. Можно составить систему уравнений:
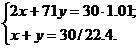
Решив систему, получим x = 0.94, y = 0.40. Следовательно, Cl2 был взят в недостатке.
n(HCl) = 2 × 0.40 = 0.80 моль.
Q = 0.80 × 92 = 73.6 кДж.
Ответ: 73.6 кДж.
7. 1) CuCl2 + 2KOH → Cu(OH)2¯ + 2KCl;
2) Cu(OH)2 + 2HNO3 → Cu(NO3)2 + 2H2O;
t°
3) 2Cu(NO3)2 → 2CuO + 4NO2↑ + O2↑;
4) CuO + CO → Cu + CO2;
t°
5) Cu + Br2 → CuBr2;
6) CuBr2 + 2CH3COOAg → (CH3COO)2Cu + 2AgBr¯.
Ответ: X – Cu(OH)2, Y – CuO, Z – CuBr2.
8. 1) CH3–CH2–CH2–OH + HBr → CH3–CH2–CH2Br + H2O;
2) CH3–CH2–CH2Br + 2Na → CH3–(CH2)4–CH3 + 2NaBr;
Pt, 200°C
3) CH3–(CH2)4–CH3 –→ C6H6 + 4H2;
AlCl3
4) C6H6 + CH3Cl → C6H5–CH3 + HCl;
5) 5C6H5–CH3 + 6KMnO4 + 9H2SO4 → 5C6H5–COOH + 3K2SO4 + 6MnSO4 + 14H2O;
H+
6) C6H5–COOH + CH3OH → C6H5–COOCH3 + H2O.
9. Медь осаждается щелочью, а алюминий образует растворимый алюминат калия:
Cu(NO3)2 + 2KOH → Cu(OH)2¯ + 2KNO3;
Al(NO3)3 + 4KOH → K[Al(OH)4] + 3KNO3;
t°
Cu(OH)2 → CuO + H2O.
n(CuO) = 2.40 / 80 = 0.03 = n(Cu(NO3)2);
c (Cu(NO3)2) = 0.03 / 0.075 = 0.4 М.
Аммиак осаждает гидроксид алюминия, а соль меди дает с аммиаком растворимый комплекс:
Al(NO3)3 + 3NH3 + 3H2O → Al(OH)3¯ + 3NH4NO3;
Cu(NO3)2 + 4NH3 → [Cu(NH3)4](NO3)2;
t°
2Al(OH)3 → Al2O3 + 3H2O.
n(Al2O3) = 1.53 / 102 = 0.015, n(Al(NO3)3) = 2×0.015 = 0.03.
c (Al(NO3)3) = 0.03 / 0.075 = 0.4 М.
Ответ: 0.4 М Cu(NO3)2, 0.4 M Al2(SO4)3.
10. С соляной кислотой анилин образует соль:
n(C6H5–NH2) = n(HCl) = 49.7 × 0.17 × 1.08 / 36.5 = 0.25 моль;
m (C6H5–NH2) = 0.25 × 93 = 23.25 г;
m (C6H2Br3–NH2) = 0.25 × 330 = 82.5 г;
w(C6H5–NH2) = 23.25 / 80 × 100% = 29.06%.
С бромной водой взаимодействует метилфенол:
m (CH3–C6H2Br2–OH) = 135.7 – 82.5 = 53.2 г;
n(CH3–C6H2Br2–OH) = 53.2 / 266 = 0.2 моль;
m (CH3–C6H4–OH) = 0.2 × 108 = 21.6 г;
w(CH3–C6H4–OH) = 21.6 / 80 × 100% = 27.0%.
Количество бензола находим по разности:
m (C6H6) = 80 – 23.25 – 21.6 = 35.15 г;
w(C6H6) = 35.15 / 80 × 100% = 43.94%.
Ответ: w(C6H5–NH2) = 29.06%, w(CH3–C6H4–OH) = 27.0%, w(C6H6) = 43.94%.
Решение варианта ХБ-2004-1
1.
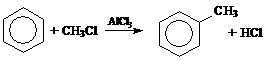
2. Растворение труднорастворимой соли описывается уравнением:
Ag2SO3 ⇄ 2Ag+ + SO32–.
s 2s s
Здесь s – это молярная концентрация (моль/л).
ПР(Ag2SO3) = [Ag+]2[SO32–] = (2 s)2 · s = 4 s 3;
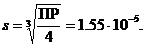
Ответ: 1.55 · 10–5 моль/л.
3. Реакция нейтрализации:
KOH + HCl ® KCl +H2O.
n(HCl) = 2 · 0.05 = 0.1 моль;
n(KOH) = 1.082 · 18.12 · 0.1 / 56 = 0.035 моль.
В результате реакции нейтрализации полностью прореагировало 0.035 моль KOH с выделением 1.96 кДж теплоты, а при взаимодействии 1 моль KOH с HCl соответственно выделится
1.96 / 0.035 = 56 кДж.
Ответ: 56 кДж/моль.
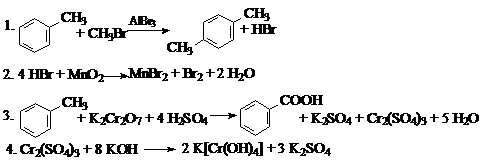 4.
4.
Ответ: A – HBr, B – Cr2(SO4)3.
5. Масса образца неизвестного металла m (Me) = r × V = 2.7 × 7.5 = 20.25 г.
1 моль металла содержит 6.02 × 1023 × n валентных электронов (n – число валентных электронов в одном атоме). Пусть А – атомная масса металла, тогда количество вещества этого металла составляет
n(Me) = 20.25 / A.
В нем содержатся 13.5×1023 валентных электронов, что составляет
13.5×1023 / (6.02×1023 · n) = 2.24 / n моль.
Тогда 20.25 / А = 2.24 / n, или A = 9 n.
Подставляя n = 1, 2, 3…, получаем при n = 3 значение А = 27 г/моль, это алюминий Al.
Электронная конфигурация: 13Al 1 s 22 s 22 p 63 s 23 p 1.
Ответ: алюминий.
6. По окончании реакции в растворе содержатся соли AlCl3 и NaCl.
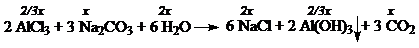
Пусть масса исходного раствора AlCl3 равна m г.
М (NaCl) = 58.5 г/моль, М (AlCl3) = 133.5 г/моль.
Т.к. в конечном растворе по условию w(NaCl) = w(AlCl3), составляем уравнение
58.5 × 2 x = 0.08 m – 2/3 × x × 133.5, или m = 2575 x.
m фильтрата = 2 m – m (Al(OH)3) – m (CO2) = 2 × 2527 x – 2/3 × x × 78 – 44 × x = 5054 x.
Т.о. в конечном растворе массовые доли солей составляют
w(AlCl3) = w(NaCl) = 2 x × 58.5 / 5054 x = 0.0231 (2.31%);
В исходном растворе
w(Na2CO3) = 106 x / m = 106 x / 2575 x = 0.0412 (4.12%).
Ответ: w(AlCl3) = w(NaCl) = 2.31%, w(Na2CO3) = 4.12%.
7. а) PH3 + 2O2 → H3PO4;
б) 3Zn + KClO3 + 6KOH + 3H2O → 3K2[Zn(OH)4] + KCl;
в) MnO2 + 2NaBr + 2H2SO4 → Br2 + MnSO4 + Na2SO4 + 2H2O.
8. Определим молекулярную формулу искомого углеводорода:
n(C): n(H) = 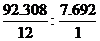 = 1: 1. Простейшая формула – СН.
= 1: 1. Простейшая формула – СН.
Углеводородом А, который соответствует предложенной схеме превращений, может быть стирол С8Н8.
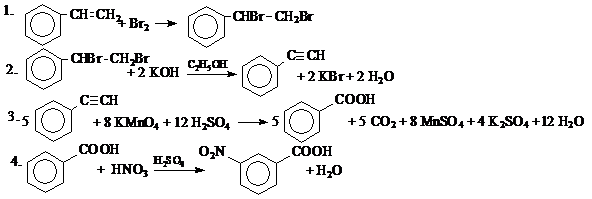
Ответ:
9. В результате обжига неизвестного сульфида Me2S (M = 2 x + 32, где х – это А (Ме)) в избытке кислорода
b 2 b
Me2S + 2O2 → 2MeO + SO2
образовалось 2 b молей оксида МеО (b = 3.2 / (2 x + 32)), для растворения которого потребовалось 2 b молей H2SO4:
2 b 2 b 2 b
MeO + H2SO4 → MeSO4 + H2O.
Масса необходимого количества 39.2%-ного раствора H2SO4 составляет
2 b × 98 / 0.392 = 500 b г.
Общая масса раствора составляет
m (MeO) + m (р-ра H2SO4) = 2 b (x + 16) + 500 b = b (2 x + 532) г.
Масса соли в растворе m (MeSO4) = 2 b (x + 96) г.
По условию задачи массовая доля MeSO4 составляет 48.5%, отсюда:
2 b (x + 96) = 0.485(2 x + 532) b,
x = 64 (Ме – это медь).
Исходный сульфид – Cu2S, в растворе содержится соль CuSO4 массой
m (CuSO4) = 2 b × 160 = 2 × 0.02 × 160 = 6.4 г.
Исходная масса раствора равна 0.02 (64 × 2 + 532) = 13.2 г.
При охлаждении полученного раствора выпало 2.5 г кристаллогидрата, следовательно общая масса раствора стала равна 13.2 – 2.5 = 10.7 г. Масса CuSO4 в оставшемся растворе равна 10.7 × 0.449 = 4.8 г, в выпавших кристаллах содержится 6.4 – 4.8 = 1.6 г CuSO4, что соответствует 0.01 моль. Масса воды в кристаллах равна 2.5 – 1.6 = 0.9 г, что соответствует 0.05 моль. Таким образом, формула кристаллогидрата –
CuSO4 × 5Н2О.
Ответ: CuSO4 × 5Н2О.
10. 2KMnO4 + 16HBr ® 2MnBr2 + 5Br2 + 2KBr + 8H2O.
n(KMnO4) = 0.5 × 0.1 = 0.05 моль,
n(HBr) = 8 × n(KMnO4) = 0.4 моль.
По условию n(С6Н5СН3) = 27.6 / 92 = 0.3 моль.
Отношение n(HBr) / n(С6Н5СН3) = 4: 3.
При соотношении n(HBr) / n(С6Н5СН3) = 1: 1 образуется монозамещенное производное, а при соотношении 2: 1 – дизамещенное. Поэтому в данном случае могут протекать две реакции:

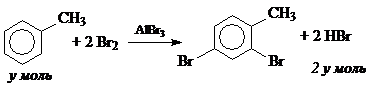
Составим систему уравнений:
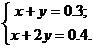
Решения системы: x = 0.2, y = 0.1.
Получено 0.2 моль 4-бромтолуола и 0.1 моль 2,4-дибромтолуола.
Ответ: 0.2 моль 4-бромтолуола, 0.1 моль 2,4-дибромтолуола.
Решение варианта ХБ-2004-2
1.
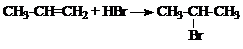
2. Растворение труднорастворимой соли описывается уравнением:
PbI2 ⇄ Pb2+ + 2I–;
s s 2s
Здесь s – это молярная концентрация (моль/л).
ПР(PbI2) = [Pb2+][I–]2 = s · (2 s)2 = 4 s 3.
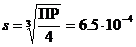
Ответ: 6.5 ×10–4 моль/л.
3. Реакция нейтрализации:
RbOH + HBr ® RbBr +H2O.
n(RbOH) = 1 × 0.1 = 0.1 моль;
n(HBr) = 64.78 × 1.042 × 0.06 / 81 = 0.05 моль.
В результате реакции нейтрализации полностью прореагировало 0.05 моль HBr с выделением 2.8 кДж теплоты, а при взаимодействии 1 моль HBr с RbOH выделится
2.8 / 0.05 = 56 кДж.
Ответ: 56 кДж/моль.
4.
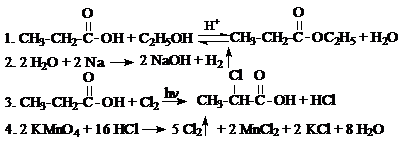
Ответ: A – H2O, B – HCl.
5. Масса образца неизвестного металла m (Me) = r × V = 3.02 × 6.5 = 19.63 г.
1 моль металла содержит 6.02×1023 × n валентных электронов (n – число валентных электронов в атоме). Пусть А – атомная масса металла, тогда количество вещества этого металла составляет
n(Me) = 19.63 / A.
В нем содержатся 7.88×1023 валентных электронов, что составляет
7.88×1023 / (6.02×1023 × n) = 1.31 / n моль.
Тогда 19.63 / А = 1.31 / n, или A = 15 n.
Подставляя n = 1, 2, 3…, получаем при n = 3 А = 45 г/моль, это скандий Sc.
Электронная конфигурация: 21Sc 1 s 22 s 22 p 63 s 23 p 63 d 14 s 2.
Ответ: скандий.
6. По окончании реакции в растворе содержатся соли CrCl3 и NaCl.
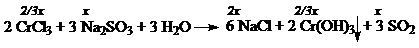
Пусть масса исходного раствора CrCl3 – m. Т.к. в конечном растворе по условию w(NaCl) = w(CrCl3), то
58.5 × 2 x = 0.06 m – 2/3 × x × 158.5,
m = 3711.11 x.
m фильтрата = 2 m – m (Cr(OH)3) – m (SO2) = 2 × 3711.11 x – 2/3 × x × 103 – 64 x = 7289.55 x.
Т.о. в конечном растворе массовые доли солей:
w(CrCl3) = w(NaCl) = 2 x × 58.5 / 7289.55 x = 0.0161 (или 1.61%);
В исходном растворе
w(Na2SO3) = 126 x / m = 126 x / 3711.11 x = 0.0339 (или 3.39%).
Ответ: w(CrCl3) = w(NaCl) = 1.61%, w(Na2CO3) = 3.39%.
7. а) Ca3N2 + 8HCl → 3CaCl2 + 2NH4Cl;
б) 8Al + 3KNO3 + 5KOH + 18H2O → 8K[Al(OH)4] + 3NH3;
в) 2NaI + 2NaNO2 + 2H2SO4 → 2NO↑ + I2↓ + 2Na2SO4 + 2H2O.
8. Определим молекулярную формулу искомого углеводорода
n(C): n(H) = 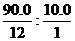 = 3: 4. Простейшая формула – С3Н4.
= 3: 4. Простейшая формула – С3Н4.
Углеводородом А, который соответствует предложенной схеме превращений, может быть пропин С3Н4.
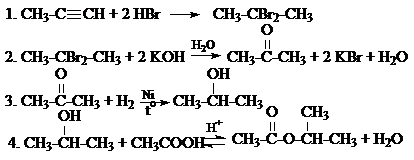
Ответ: A – CH3–C ≡ CH; Б – CH3–CBr2–CH3;
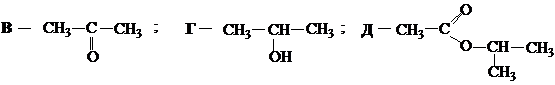 .
.
9. В результате обжига неизвестного сульфида MeS (M = x + 32, где х – это А (Ме)) в избытке кислорода
b 0.5 b
4MeS + 7O2 → 2Me2O3 + 4SO2
образовалось 0.5 b молей оксида Ме2О3 (b = 1.76 / (x + 32)), для растворения которого потребовалось 1.5 b молей H2SO4:
0.5b 1.5b 0.5b
Me2O3 + 3H2SO4 → Me2(SO4)3 + 3H2O.
Масса 29.4%-ного раствора H2SO4 составляет 1.5 b × 98 / 0.294 = 500 b г.
Общая масса раствора составляет
m (Me2O3) + m (р-ра H2SO4) = 0.5 b · (2 x + 48) + 500 b = b (x + 524) г.
Масса соли в растворе m (Me2(SO4)3) = 0.5 b (2 x + 288)г.
По условию, массовая доля Me2(SO4)3 равна 34.5%:
0.5 b (2 x + 288) = 0.345(x + 524) b,откуда x = 56 (Ме – это железо).
Исходный сульфид FeS, в растворе содержится соль Fe2(SO4)3 массой
0.5 b × 400 = 0.5 × 0.02 × 400 = 4 г. Исходная масса раствора равна 0.02(56 + 524) = 11.6 г.
При охлаждении полученного раствора выпало 2.9 г кристаллогидрата, следовательно общая масса раствора стала равна 11.6 – 2.9 = 8.7 г. Масса Fe2(SO4)3 в оставшемся растворе равна 8.7 × 0.23 = 2 г.В выпавших кристаллах содержится 4 – 2 = 2 гFe2(SO4)3, что соответствует 0.005 моль.Масса воды в кристаллах равна 2.9 – 2 = 0.9 г, что соответствует 0.05 моль.
Таким образом, искомая формула кристаллогидрата – Fe2(SO4)3 × 10Н2О.
Ответ: Fe2(SO4)3 × 10Н2О.
10. K2Cr2O7 + 14HBr ® 2KBr + 3Br2 + 2CrBr3 + 7H2O.
n(K2Cr2O7) = 0.2 × 0.125 = 0.025 моль,
n(HBr) = 14× n(K2Cr2O7) = 0.35 моль.
По условию задачи n(С6Н5С2Н5) = 15.9 / 106 = 0.15 моль.
Соотношение n(HBr) / n(С6Н5СН3) = 2.33: 1.
При соотношении n(HBr) / n(С6Н5С2Н5) = 2: 1 образуется дизамещенное производное, а при соотношении 3: 1 – тризамещенное. Поэтому в данном случае могут протекать 2 реакции:
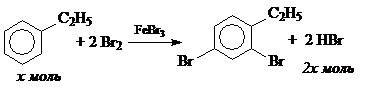
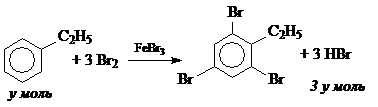
Составим систему уравнений:
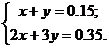
Решения системы: x = 0.1 моль, y = 0.05 моль.
Получено 0.1 моль 2,4-дибромэтилбензола и 0.05 моль 2,4,6-трибромэтилбензола. 
Ответ: 0.1 моль 2,4-дибромэтилбензола, 0.05 моль 2,4,6-трибромэтилбензола.
Ответы и указания к варианту ХБ-2004-3
2. 6.7×10–5 моль/л.
3. 56 кДж/моль.
4. A – Na2CO3, B – NaCl.
5. Цинк.
6. w(Al2(SO4)3) = w(K2SO4) = 3.07%, w(K2S) = 3.82%.
9. CuCl2 × 2Н2О.
10. 0.3 моль 4-бромизопропилбензола, 0.15 моль 2,4-дибромизопропилбензола.
Ответы и указания к варианту ХБ-2004-4
2. 1.58 × 10–2 моль/л.
3. 56 кДж/моль.
4. A – H2O, B – S.
5. Кадмий.
6. w(Cr2(SO4)3) = w(Na2SO4) = 2.12%, w(Na2CO3) = 3.11%.
9. Fe(NO3)3 × 9Н2О.
10. 0.08 моль 2,4-дибромпропилбензола и 0.16 моль 2,4,6-трибромпропилбензола.
Решение варианта BБ-2004-1
1. C8H14N2O5 + H2O ® C5H9NO4 + X.
Ответ: X – C3H7NO2.
2. Минимальная степень окисления (–1) – HBr, KBr.
Максимальная (+7) – HBrO4, KBrO4.
3. Исходная смесь: M 1 = 8.5 г/моль, V 1 = 40 л.
Добавили: M 2 = 28 г/моль, V 2 = 20 л.
Конечная смесь: 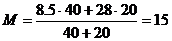 г/моль.
г/моль.
Плотность смеси по водороду DH2 = 15 / 2 = 7.5.
Ответ: 7.5.
4. Схема трехстадийного синтеза: CH4 ® C2H2 ® C2H4 ® C2H4(OH)2.
1) 2CH4 ® C2H2 + 3H2;
2) C2H2 + H2 ® C2H4;
3) 3C2H4 + 2KMnO4 + 4H2O ® 3C2H4(OH)2 + 2MnO2 + 2KOH.
5. n(CO2) = 16.8 / 22.4 = 0.75 моль.
n(KOH) = 400 × 0.28 / 56 = 2 моль – избыток.
Протекает реакция CO2 + 2KOH → K2CO3 + H2O.
n(K2CO3) = 0.75 моль, m (K2CO3) = 0.75×138 = 103.5 г.
nост(KOH) = 2 – 1.5 = 0.5 моль, m ост(KOH) = 0.5×56 = 28 г.
Ответ: 103.5 г K2CO3, 28 г KOH.
6. а) H2S ⇄ H+ + HS–.
a» 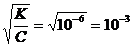 .
.
б) H2S ⇄ H+ + HS–;
HCl ® H+ + Cl–.
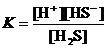 ;
;
[H+] = 1 + [HS–]» 1 М;
[H2S] = 0.1 – [HS–]» 0.1 М.
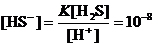 М
М
a» [HS–] / C = 10–8 / 0.1 = 10–7.
Ответ: а) 10–3; б) 10–7.
7. 1) Ca3(PO4)2 + H3PO4 → 3CaHPO4;
t °
2) 2CaHPO4 + 5C +2SiO2 → 2P + 2CaSiO3 + 5CO↑ + H2O;
t °
3) 4P + 3KOH + 3H2O → PH3 + 3KH2PO2;
4) PH3 + 2O2 → H3PO4;
5) 2H3PO4 + Ca(OH)2 → Ca(H2PO4)2 + 2H2O;
6) Ca(H2PO4)2 + 2Ca(OH)2 → Ca3(PO4)2 + 4H2O.
8. hn
1) C6H5CH3 + Br2 ® C6H5CH2Br + HBr;
2) C6H5CH2Br + KOH ® C6H5CH2OH + KBr;
3) 5C6H5CH2OH + 4KMnO4 + 6H2SO4 ® 5C6H5COOH + 2K2SO4 + 4MnSO4 +
+ 11H2O;
4) C6H5COOH + NH3 ® C6H5COONH4;
5) 2C6H5COONH4 + Ba(OH)2 ® (C6H5COO)2Ba + 2NH3↑ + 2H2O;
6) (C6H5COO)2Ba + Na2SO4 ® 2C6H5COONa + BaSO4¯.
9. Пусть формула оксида неметалла ЭО х. В случае четной валентности неметалла реакция между NaOH и оксидом неметалла описывается следующим уравнением:
2NaOH + ЭО х → Na2ЭО х + 1 + H2O.
Найдем массу конечного раствора, содержащего соль:
m р-ра = 10.16 + 124 = 134.16.
Отсюда следует, что масса соли Na2ЭО х +1 равна
m = 134.16 · 0.1127 = 15.12 г.
В процессе реакции из-за вхождения Na2O в состав соли изменение массы составило
15.12 – 10.16 = 4.96 г. Отсюда n(Na2O) = n(ЭО х) = 0.08 моль, следовательно,
M (ЭО х) = 10.16/0.08 = 127. Если х = 2, то М (Э) = 95 (такого неметалла нет).
Если х = 3, то М (Э) = 79. Это Se.
Найдем массовую долю NaOH в конечном растворе. К оксиду неметалла добавили 12.4 г NaOH, в реакцию вступило 0.16 моль или 6.4 г, поэтому
w(NaOH) = 6/134.16 = 0.0447 (или 4.47%).
Ответ: SeO3, Na2SeO4, w(NaOH) = 4.47%.
10. Общая формула обоих гомологических рядов C n H2 n –5N.
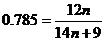 , n = 7.
, n = 7.
С бромоводородом оба изомера реагируют по уравнению:
C7H9N + HBr ® C7H10NBr.
nобщ(C7H9N) = n(HBr) = 1.21 × 101.3 / (8.314 × 295) = 0.05 моль.
С бромной водой реагирует только гомолог анилина.
n(Br2) = 500 × 0.032 / 160 = 0.1 моль.
Гомолог анилина содержит один атом углерода в боковой цепи. Если бы этот атом был в орто- или пара-положении по отношению к группе NH2, то вещество реагировало бы с двойным количеством брома:
CH3C6H4NH2 + 2Br2 ® CH3C6H2Br2NH2 + 2HBr,
но в этом случае n(CH3C6H4NH2) = 0.1 / 2 = 0.05 моль, что невозможно. Поэтому реакция идет с тройным количеством брома, что возможно только в случае мета-положения заместителя:

n(гом.анилина) = 0.1 / 3 = 0.033 моль,
n(гом.пиридина) = 0.05 – 0.033 = 0.017 моль.
Массовые доли изомеров равны мольным долям:
w(гом.анилина) = 0.033 / 0.05 = 0.67,
w(гом.пиридина) = 1 – 0.67 = 0.33.
Гомолог пиридина может иметь любое строение: с одной (этилпиридин) или двумя (диметилпиридин) боковыми цепями, например:
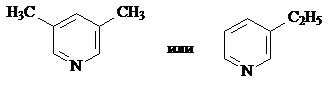
Ответ: 3-метиланилин, любой диметил- или этилпиридин. w(гом.анилина) = 0.67, w(гом.пиридина) = 0.33.
Решение варианта BБ-2004-2
1. C12H16N2O5 + H2O ® C9H11NO3 + X.
Ответ: X – C3H7NO3.
2. Минимальная степень окисления (–1) – HI, KI. Максимальная (+7) – I2O7, H5IO6.
3. Исходная смесь: M 1 = 36 г/моль, V 1 = 100 л.
Добавили: M 2 = 44 г/моль, V 2 = 100 л.
Конечная смесь: 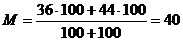 г/моль.
г/моль.
Плотность по водороду:DH2 = 40 / 2 = 20.
Ответ: DH2 = 20.
4. Схема синтеза: CH4 ® C2H2 ® CH3CHO ® C2H5OH; CH3CHO ® CH3COOH.
t°
1) 2CH4 ® C2H2 + 3H2;
Hg2+, Н+
2) C2H2 + H2O ––® CH3CHO;
t°, Ni
3) CH3CHO + H2 ® C2H5OH;
NH3
4) CH3CHO + Ag2O ® CH3COOH + 2Ag↓;
H2SO4(конц)
5) C2H5OH + CH3COOH ––––––® CH3COOC2H5 + H2O.
5. n(SO2) = 14.56 / 22.4 = 0.65 моль,
n(NaOH) = 200×0.17 / 40 = 0.85 моль.
1 < n(NaOH)/n(SO2) < 2, следовательно одновременно образуются средняя и кислая соли:
SO2 + 2NaOH → Na2SO3 + H2O;
SO2 + NaOH → NaHSO3.
Пусть в первую реакцию вступит x моль SO2, а во вторую – y моль SO2.
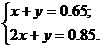
Решив систему уравнений, получим x = 0.2, y = 0.45.
n(Na2SO3) = 0.2 моль, m (Na2SO3) = 0.2×126 = 25.2 г,
n(NaHSO3) = 0.45 моль, m (NaHSO3) = 0.45×104 = 46.8 г.
Ответ: 25.2 г Na2SO3, 46.8 г NaHSO3.
6. а) H2S ⇄ H+ + HS–;
a» 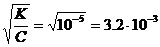 .
.
б) H2S ⇄ H+ + HS–;
HCl ® H+ + Cl–;
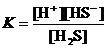 .
.
[H+] = 0.1 + [HS–]» 0.1 М;
[H2S] = 0.01 – [HS–]» 0.01 М;
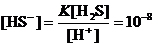 М;
М;
a» [HS–] / C = 10–8 / 0.01 = 10–6.
Ответ: а) 3.2×10–3; б) 10–6.
7. 1) 3MnO2 + 4Al → 3Mn + 2Al2O3;
2) Mn + 4HNO3 → Mn(NO3)2 + 2NO2↑ + 2H2O;
t°
3) Mn(NO3)2 → MnO2 + 2NO2↑;
4) MnO2 + 4HBr → MnBr2 + Br2 + 2H2O;
5) MnBr2 + Cl2 → MnCl2 + Br2;
6) MnCl2 + 2CH3COOAg → (CH3COO)2Mn + 2AgCl¯.
8. t °, кат
1) C7H16 –––® C6H5CH3 + 4H2;
2) 5C6H5CH3 + 6KMnO4 + 9H2SO4 ® 5C6H5COOH + 3K2SO4 + 6MnSO4 + 14H2O;
3) C6H5COOH + NH3 ® C6H5COONH4;
4) C6H5COONH4 + NaOH ® C6H5COONa + NH3↑ + H2O;
t°
5) C6H5COONa + NaOH ® C6H6 + Na2CO3;
H2SO4(конц)
6) C6H6 + HNO3 ––––® C6H5NO2 + H2O.
Ответ: X – C6H5CH3, Y – C6H5COONH4, Z – C6H6.
9. Пусть формула оксида неметалла ЭО х. В случае четной валентности неметалла реакция между NaOH и оксидом неметалла описывается следующим уравнением:
2NaOH + ЭО х → Na2ЭО х +1 + H2O.
Найдем массу конечного раствора, содержащего соль:
m р-ра = 9.6 + 108 = 117.6 г.
Отсюда следует, что масса соли Na2ЭО х +1 равна 117.6 · 0.1449 = 17.04 г.
В процессе реакции из-за вхождения Na2O в состав соли изменение массы составило
17.04 – 9.6 = 7.44 г.
Отсюда n(Na2O) = n(ЭО х) = 0.12, следовательно, M(ЭО х) = 9.6 / 0.12 = 80.
Если х = 2, то М(Э) = 48 (такого неметалла нет). Если х = 3, то М(Э) = 32. Это S.
Найдем массовую долю NaOH в конечном растворе. К оксиду неметалла добавили 10.8 г NaOH, в реакцию вступило 0.24 моль или 9.6 г, поэтому
w(NaOH) = 1.2 / 117.6 = 0.01 (или 1%).
Ответ: SO3, Na2SO4, w(NaOH) = 1%.
10. Общая формула обоих гомологических рядов: C n H2 n –5N.
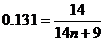 , n = 7.
, n = 7.
С хлороводородом оба изомера реагируют по уравнению:
C7H9N + HCl ® C7H10NCl.
nобщ(C7H9N) = n(HCl) = 0.95 × 101.3 / (8.314 × 289.5) = 0.04 моль.
С бромной водой реагирует только гомолог анилина.
n(Br2) = 320×0.04 / 160 = 0.08 моль.
Гомолог анилина содержит один атом углерода в боковой цепи. Если бы этот атом был в орто- или пара-положении по отношению к NH2, то вещество реагировало бы с двойным количеством брома:
CH3C6H4NH2 + 2Br2 ® CH3C6H2Br2NH2 + 2HBr,
но в этом случае n(CH3C6H4NH2) = 0.08 / 2 = 0.04 моль, что невозможно. Поэтому реакция идет с тройным количеством брома, что возможно только в случае мета-положения заместителя:

n(гом.анилина) = 0.08 / 3 = 0.027 моль,
n(гом.пиридина) = 0.04 – 0.027 = 0.013 моль.
Массовые доли изомеров равны мольным долям:
w(гом.анилина) = 0.027 / 0.04 = 0.67,
w(гом.пиридина) = 1 – 0.67 = 0.33.
Гомолог пиридина может иметь любое строение: с одной (этилпиридин) или двумя (диметилпиридин) боковыми цепями, например:
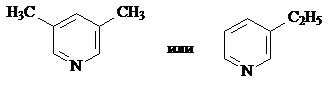
Ответ: 3-метиланилин, любой диметил- или этилпиридин. w(гом.анилина) = 0.67, w(гом.пиридина) = 0.33.
Ответы и указания к варианту BБ-2004-3
1. C7H8O.
2. Минимальная – H2Se, K2Se; максимальная – SeO3, H2SeO4.
3. DH2 = 6.5.
4. CH4 ® C2H2 ® CH3CHO ® C2H5OH ® (C2H5)2O.
5. 27.6 г K2CO3, 15 г KHCO3.
6. а) 4.2×10–3; б) 1.8×10–5.
9. SeO3, K2SeO4, w(KOH) = 7.6%.
10. 3-этиланилин или 3,5-диметиланилин, любой гомолог пиридина с тремя атомами углерода в боковых цепях. w(гом.анилина) = 0.67, w(гом.пиридина) = 0.33.
Ответы и указани
 2018-01-21
2018-01-21 1663
1663