1. При определенной концентрации и температуре HNO3 реагирует с Zn с образованием NO2 и NO в мольном соотношении NO2: NO = 1: 3. Сколько моль HNO3 реагирует с 1 моль Zn?
2. В результате серии последовательных радиоактивных распадов нуклид 235U превращается в нуклид 207Pb. Сколько a- и b-распадов включает эта серия ядерных превращений?
3. Общее количество атомов в образце предельной одноосновной карбоновой кислоты массой 97.5 г равно 13.0 моль. Определите молекулярную формулу кислоты.
4. В молекуле алкана содержится x первичных и y третичных атомов углерода. Найдите число четвертичных атомов углерода.
5. Вычислите рН раствора, полученного при смешении равных объемов 0.04 М раствора гидроксида натрия и 0.02 М раствора бромоводородной кислоты.
6. При действии концентрированной серной кислоты на 18.2 г твердого фторида щелочного металла выделился газ, при пропускании которого через раствор Ca(OH)2 образовалось 27.3 г осадка. Назовите неизвестный металл.
7. При дегидрировании 95.0 г гомолога бензола образовался непредельный углеводород (с одной двойной связью), который может присоединить 76.0 г брома. Напишите все возможные структурные формулы исходного углеводорода, если выход первой реакции равен 60%, а второй – 100%.
8. В равновесной смеси при некоторой температуре содержится 6.0 моль HI, 3.0 моль H2 и 0.8 моль I2. При охлаждении константа равновесия H2 + I2 ⇄ 2HI увеличилась
в 2 раза. Рассчитайте количества веществ в новой равновесной смеси.
9. Комплексное соединение платины содержит 50.13 мас.% Pt, 7.20 мас.% N, 41.13 мас.% Br и водород. Комплекс не заряжен, а его молекула имеет плоское строение. Установите молекулярную формулу комплекса и определите валентность центрального атома. Изобразите структурные формулы двух геометрических изомеров комплекса.
10. Напишите уравнения реакций, соответствующие следующей схеме превращений:
C7H16NCl ← C7H15N ← C7H9N → C7H8N2O2 → C6H3N2O4K → C5H4N2O2 → C5H6N2.
В уравнениях укажите структурные формулы веществ и условия реакций.
11. В калориметре смешали 10.0 мл 0.50 M раствора HCl и 10.0 мл 0.50 М раствора NaOH, имеющих одинаковую температуру. Было зафиксировано повышение температуры на D T. Оцените, как изменится температура, если использовать 5.0 мл 0.50 M раствора NaOH вместо 10.0 мл. Считайте удельные теплоемкости обоих растворов одинаковыми.
12. Напишите уравнения химических реакций, соответствующие следующей схеме превращений:
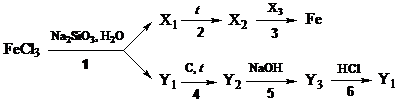
Определите неизвестные вещества.
13. Навеску смеси гидрида бария и нитрида лития разделили на две равные части. Одну часть растворили в воде, а вторую – в избытке соляной кислоты. Объем газа, выделившегося в реакции с водой, в полтора раза больше, чем в реакции с соляной кислотой (растворимостью газов в воде пренебречь). Определите массовую долю гидрида бария в исходной смеси.
14. В замкнутом сосуде в молярном соотношении 1:1 при температуре 398 K смешали CO и Cl2. Через 5 минут после введения катализатора давление в системе оказалось равным 2.3×105 Па, скорость образования фосгена (COCl2) в этом промежутке времени составила 2.5×10–3 моль/(л×мин). Рассчитайте давление хлора в исходной смеси.
15. При пропускании через 160 мл раствора, содержащего смесь Bi(NO3)3 и Hg(NO3)2, тока силой 0.90 А в течение 161 минуты на катоде выделилась смесь металлов общей массой 7.195 г. Напишите уравнения электролиза каждой соли и определите молярные концентрации солей в исходном растворе, если известно, что на катоде не выделялись газы, а после окончания электролиза раствор не содержит ионов металлов.
16. Оптически активный сложный диэфир A состоит только из атомов C, H и O. 2.81 г этого вещества подвергли омылению 30.0 мл 1.00 M раствора NaOH. Для того, чтобы полностью нейтрализовать непрореагировавший NaOH, потребовалось 6.0 мл 1.00 M раствора HCl. Продуктами омыления являются: дикарбоновая кислота B, метанол и оптически активный спирт C. В результате реакции спирта C с I2/NaOH образуются желтый осадок и C6H5COONa. Соединение B обесцвечивает бромную воду, а при дегидратации образует циклический ангидрид D. Изобразите структурные формулы веществ A, B, C и D.
17. Получение алканов по методу Фишера-Тропша протекает на кобальтовом катализаторе по схеме: CO + H2 ® C n H2 n +2 + H2O. Оксид углерода (II) и водород в объемном соотношении 1: 2 ввели в реакцию при 180 оС, при этом образовалась смесь метана, этана и пропана в молярном соотношении 3: 2: 2. Вычислите, во сколько раз изменилось общее давление в системе, если синтез проходил при неизменных температуре и объеме, при этом прореагировало 10% СО.
18. При нагревании природного дипептида с концентрированной соляной кислотой образовались два продукта; массовая доля хлора в одном из них составила 28.29%. При реакции этого же дипептида с разбавленной соляной кислотой образовался продукт, в котором массовая доля хлора равна 16.71%. Установите аминокислотный состав дипептида, напишите для него две возможные структурные формулы.
Вариант О-2004-1
1. Напишите уравнение щелочного гидролиза этилформиата.
2. Чему равен молярный объем бензола, если его плотность равна 0.879 г/см3?
3. Даны вещества: оксид натрия, оксид углерода (IV), карбонат калия, сульфат натрия. Какую среду будут иметь растворы, полученные добавлением этих веществ к воде? Напишите уравнения соответствующих реакций в ионном виде.
4. В предельной одноосновной карбоновой кислоте массовая доля кислорода равна 43.24%. Определите формулу кислоты.
5. Запишите уравнение диссоциации акриловой кислоты C3H4O2. Рассчитайте степень диссоциации кислоты в 0.030 М растворе, если pH этого раствора равен 2.90.
6. В закрытой стеклянной колбе объемом 50 л находится при нормальных условиях смесь водорода и хлора, имеющая плотность 1.32 г/л. Сколько теплоты выделится при освещении колбы синим светом? Теплота образования HCl составляет 92 кДж/моль.
7. Напишите уравнения химических реакций, соответствующие следующей схеме превращений:
AlCl3 ® X ® Al(NO3)3 ® Y ® Al ® Z ® K[Al(OH)4].
Определите неизвестные вещества.
8. Напишите уравнения химических реакций, соответствующие следующей схеме превращений:
C3H7Br ® C3H8O ® C3H6O ® C3H6O2 ® C3H5ClO2 ® C3H7NO2 ® C4H9NO2.
В уравнениях укажите структурные формулы веществ и условия протекания реакций.
9. Раствор, содержащий сульфаты меди (II) и алюминия, разделили на две равные части объемом 50 мл каждая. К первой части добавили избыток щелочи, осадок отделили и прокалили; масса сухого остатка составила 1.40 г. Ко второй части добавили избыток раствора аммиака, осадок отделили и прокалили; масса сухого остатка составила 0.765 г. Определите молярные концентрации солей в исходном растворе.
10. В смесь массой 100 г, состоящую из бензола, 4-метилфенола и анилина, пропустили избыток сухого хлороводорода, при этом выпало 38.85 г осадка, который отфильтровали. Фильтрат обработали избытком бромной воды, при этом образовался осадок массой 53.2 г. Вычислите массовые доли веществ в исходной смеси.
Вариант О-2004-2
1. Напишите уравнение кислотного гидролиза метилацетата.
2. Чему равен молярный объем гексана, если его плотность равна 0.660 г/см3?
3. Даны вещества: оксид кальция, оксид серы (IV), ацетат калия, нитрат натрия. Какую среду будут иметь растворы, полученные добавлением этих веществ к воде? Напишите уравнения соответствующих реакций в ионном виде.
4. В монохлоралкане массовая доля хлора равна 55.04 %. Определите формулу монохлоралкана.
5. Запишите уравнение диссоциации бензойной кислоты C7H6O2. Рассчитайте степень диссоциации кислоты в 0.025 М растворе, если pH этого раствора равен 2.91.
6. В закрытой стеклянной колбе объемом 30 л находится при нормальных условиях смесь водорода и хлора, имеющая плотность 1.01 г/л. Сколько теплоты выделится при освещении колбы синим светом? Теплота образования HCl составляет 92 кДж/моль.
7. Напишите уравнения химических реакций, соответствующие следующей схеме превращений:
CuCl2 ® X ® Cu(NO3)2 ® Y ® Cu ® Z ® (CH3COO)2Cu.
Определите неизвестные вещества.
8. Напишите уравнения химических реакций, соответствующие следующей схеме превращений:
C3H8O ® C3H7Br ® C6H14 ® C6H6 ® C7H8 ® C7H6O2 ® C8H8O2.
В уравнениях укажите структурные формулы веществ и условия протекания реакций.
9. Раствор, содержащий нитраты меди (II) и алюминия, разделили на две равные части объемом 75 мл каждая. К первой части добавили избыток щелочи, осадок отделили и прокалили; масса сухого остатка составила 2.40 г. Ко второй части добавили избыток раствора аммиака, осадок отделили и прокалили; масса сухого остатка составила 1.53 г. Определите молярные концентрации солей в исходном растворе.
10. На нейтрализацию смеси массой 80 г, состоящей из бензола, 4-метилфенола и анилина, пошло 49.7 мл 17% -ной соляной кислоты (плотность 1.08). При взаимодействии такого же количества смеси с избытком бромной воды образовался осадок массой 135.7 г. Вычислите массовые доли веществ в исходной смеси.
Вариант ХБ-2004-1
1. Приведите уравнение реакции электрофильного замещения.
2. Произведение растворимости Ag2SO3 при 25°C составляет 1.5 · 10–14 моль3/л3. Рассчитайте концентрацию соли (моль/л) в насыщенном водном растворе.
3. При сливании 18.12 мл 10%-ного раствора KOН (плотность 1.082 г/мл) и 50 мл 2М раствора HCl выделилось 1.96 кДж теплоты. Рассчитайте тепловой эффект реакции нейтрализации.
4. Напишите уравнения реакций, соответствующих следующей схеме превращений:
Br2 ← A ← C7H8 → B → K[Cr(OH)4].
Укажите условия проведения реакций.
5. В 7.5 см3 неизвестного металла содержится 13.5 ∙ 1023 валентных электронов (плотность металла 2.7 г/см3). Определите металл и приведите электронную конфигурацию его атома.
6. К 8%-ному раствору хлорида алюминия постепенно добавили равную массу раствора карбоната натрия. Смесь, образовавшуюся после реакции, отфильтровали и получили раствор, содержащий две соли с одинаковыми анионами и равными массовыми долями. Рассчитайте массовые доли веществ в полученном фильтрате и массовую долю карбоната натрия в исходном растворе.
7. Напишите уравнения следующих реакций:
а) PH3 + O2 →...;
б) Zn + KСlO3 + KOH→...;
в) MnO2 + NaBr + H2SO4 →...
8. Дана схема превращений:
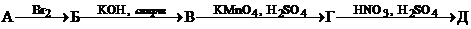 ,
,
где А – углеводород, в котором массовая доля углерода составляет 92.308%. Напишите структурные формулы веществ А–Д и уравнения соответствующих реакций.
9. 3.2 г сульфида металла, имеющего формулу Me2S (металл проявляет в своих соединениях степени окисления +1 и +2), подвергли обжигу в избытке кислорода. Твердый остаток растворен в строго необходимом количестве 39.2%-ной серной кислоты. Массовая доля соли в полученном растворе составляет 48.5%. При охлаждении этого раствора выпало 2.5 г кристаллогидрата, а массовая доля соли снизилась до 44.9%. Установите формулу кристаллогидрата.
10. В результате реакции 27.6 г толуола с бромом в присутствии бромида алюминия выделился газ в количестве, достаточном для взаимодействия с 100 мл 0.5 М раствора перманганата калия. Установите качественный и количественный состав органических соединений, полученных в результате бромирования толуола.
Вариант ХБ-2004-2
1. Приведите уравнение реакции электрофильного присоединения.
2. Произведение растворимости PbI2 при 25°C составляет 1.1 × 10–9 моль3/л3. Рассчитайте концентрацию соли (моль/л) в насыщенном водном растворе.
3. При сливании 64.78 мл 6%-ного раствора НBr (плотность 1.042 г/мл) и 100 мл 1М раствора RbOH выделилось 2.8 кДж теплоты. Рассчитайте тепловой эффект реакции нейтрализации.
4. Напишите уравнения реакций, соответствующих следующей схеме превращений:
H2 ← A ← C3H6O2 → B → Cl2.
Укажите условия проведения реакций.
5. В 6.5 см3 неизвестного металла содержится 7.88∙1023 валентных электронов (плотность металла 3.02 г/см3). Определите металл и приведите электронную конфигурацию его атома.
6. К 6%-ному раствору хлорида хрома (III) постепенно добавили равную массу раствора сульфита натрия. Смесь, образовавшуюся после реакции, отфильтровали и получили раствор, содержащий две соли с одинаковыми анионами и равными массовыми долями. Рассчитайте массовые доли веществ в полученном фильтрате и массовую долю сульфита натрия в исходном растворе.
7. Напишите уравнения следующих реакций:
а) Ca3N2 + HCl →...;
б) Al + KNO3 + KOH →...;
в) NaI + NaNO2 + H2SO4 →...
8. Дана схема превращений:
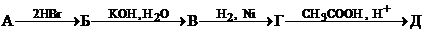 ,
,
где А – углеводород, в котором массовая доля углерода составляет 90.0%. Напишите структурные формулы веществ А-Д и уравнения соответствующих реакций.
9. 1.76 г сульфида металла, имеющего формулу MeS (металл проявляет в своих соединениях степени окисления +2 и +3), подвергли обжигу в избытке кислорода. Твердый остаток растворен в строго необходимом количестве 29.4%-ной серной кислоты. Массовая доля соли в полученном растворе составляет 34.5%. При охлаждении этого раствора выпало 2.9 г кристаллогидрата, а массовая доля соли снизилась до 23.0%. Установите формулу кристаллогидрата.
10. В результате реакции 15.9 г этилбензола с бромом в присутствии бромида железа выделился газ в количестве достаточном для взаимодействия с 125 мл 0.2 М раствора бихромата калия. Установите качественный и количественный состав органических соединений, полученных в результате бромирования этилбензола.
Вариант ХБ-2004-3
1. Приведите уравнение реакции радикального замещения.
2. Произведение растворимости Ag2CO3 при 25oC составляет 1.2×10-12 моль3/л3. Рассчитайте концентрацию соли (моль/л) в насыщенном водном растворе.
3. При сливании 18.4 мл 8%-ного раствора NaOН (плотность 1.087 г/мл) и 30 мл 2М раствора HI выделилось 2.24 кДж теплоты. Рассчитайте тепловой эффект реакции нейтрализации.
4. Напишите уравнения реакций, соответствующих следующей схеме превращений:
CO2 ← A ← C2H3O2Na → B → Cl2.
Укажите условия проведения реакций.
5. В 8.15 см3 неизвестного металла содержится 10.7∙1023 валентных электронов (плотность металла 7.13 г/см3). Определите металл и приведите электронную конфигурацию его атома.
6. К 10%-ному раствору сульфата алюминия постепенно добавили равную массу раствора сульфида калия. Смесь, образовавшуюся после реакции, отфильтровали и получили раствор, содержащий две соли с одинаковыми анионами и равными массовыми долями. Рассчитайте массовые доли веществ в полученном фильтрате и массовую долю сульфида калия в исходном растворе.
7. Напишите уравнения следующих реакций:
а) Na2O2 + CO2 →...;
б) KMnO4 + SO2 + H2O →...;
в) Na3Cr(OH)6 + Cl2 + NaOH →...
8. Дана схема превращений:
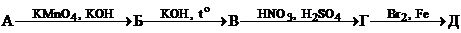 ,
,
где А – углеводород, в котором массовая доля углерода составляет 92.308%. Напишите структурные формулы веществ А–Д и уравнения соответствующих реакций.
9. 1.6 г сульфида металла, имеющего формулу Me2S (металл проявляет в своих соединениях степени окисления +1 и +2), подвергли обжигу в избытке кислорода. Твердый остаток растворен в строго необходимом количестве 29.2%-ной соляной кислоты. Массовая доля соли в полученном растворе составляет 40.9%. При охлаждении этого раствора выпало 1.71 г кристаллогидрата, а массовая доля соли снизилась до 27.6%. Установите формулу кристаллогидрата.
10. В результате реакции 54 г изопропилбензола с бромом в присутствии бромида алюминия выделился газ в количестве, достаточном для взаимодействия с 200 мл 0.5 М раствора бромата калия. Установите качественный и количественный состав органических соединений, полученных в результате бромирования изопропилбензола.
Вариант ХБ-2004-4
1. Приведите уравнение реакции нуклеофильного присоединения.
2. Произведение растворимости PbCl2 при 25°C составляет 1.6 × 10–5 моль3/л3. Рассчитайте концентрацию соли (моль/л) в насыщенном водном растворе.
3. При сливании 73.68 мл 5%-ного раствора НNO3 (плотность 1.026 г/мл) и 90 мл 1М раствора RbOH выделилось 3.36 кДж теплоты. Рассчитайте тепловой эффект реакции нейтрализации.
4. Напишите уравнения реакций, соответствующих следующей схеме превращений:
NaOH ← A ← C6H5O2N → B → Na2SO3.
Укажите условия проведения реакций.
5. В 13 см3 неизвестного металла содержится 12.03 ∙ 1023 валентных электронов (плотность металла 8.64 г/см3). Определите металл и приведите электронную конфигурацию его атома.
6. К 8%-ному раствору сульфата хрома (III) постепенно добавили равную массу раствора карбоната натрия. Смесь, образовавшуюся после реакции, отфильтровали и получили раствор, содержащий две соли с одинаковыми анионами и равными массовыми долями. Рассчитайте массовые доли веществ в полученном фильтрате и массовую долю карбоната натрия в исходном растворе.
7. Напишите уравнения следующих реакций:
а) Cl2 + Br2 + H2O → …;
б) CrCl3 + NaClO + NaOH → …;
в) KNO2 + KMnO4 + H2SO4 → …
8. Дана схема превращений:
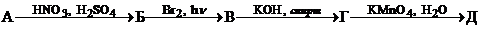 ,
,
где А – углеводород, в котором массовая доля углерода составляет 90.0%. Напишите структурные формулы веществ А–Д и уравнения соответствующих реакций.
9. 4.4 г сульфида металла, имеющего формулу MeS (металл проявляет в своих соединениях степени окисления +2 и +3), подвергли обжигу в избытке кислорода. Твердый остаток растворен в строго необходимом количестве 37.8%-ной азотной кислоты. Массовая доля соли в полученном растворе составляет 41.7%. При охлаждении этого раствора выпало 8.08 г кристаллогидрата, а массовая доля соли снизилась до 34.7%. Установите формулу кристаллогидрата.
10. В результате реакции 28.8 г пропилбензола с бромом в присутствии бромида железа выделился газ в количестве, достаточном для взаимодействия с 100 мл 0.7 М раствора манганата калия. Установите качественный и количественный состав органических соединений, полученных в результате бромирования пропилбензола.
Вариант BБ-2004-1
1. При гидролизе дипептида состава C8H14N2O5 образовалась аминокислота C5H9NO4. Определите молекулярную формулу второго продукта гидролиза.
2. Приведите по два примера соединений разных классов, в которых атом брома имеет минимальную и максимальную степень окисления.
3. Смесь водорода и азота имеет плотность по водороду 4.25. К 40 л этой смеси добавили 20 л азота. Рассчитайте плотность по водороду конечной смеси.
4. Предложите способ получения этиленгликоля, используя только метан и неорганические соединения. Напишите уравнения реакций.
5. Углекислый газ объемом 16.8 л (н.у.) поглотили 400 г 28%-ного раствора гидроксида калия. Определите, какие вещества содержатся в полученном растворе, и рассчитайте их массы.
6. Рассчитайте степень диссоциации сероводородной кислоты по первой ступени:
а) в 0.1 М растворе H2S;
б) в 0.1 М растворе H2S, содержащем 1 М HCl.
Константа диссоциации H2S по первой ступени: K 1 = 1.0×10–7.
7. Напишите уравнения химических реакций, соответствующие следующей схеме превращений:
Ca3(PO4)2 ® CaHPO4 ® P ® PH3 ® H3PO4 ® Ca(H2PO4)2 ® Ca3(PO4)2.
8. Напишите уравнения химических реакций, соответствующие следующей схеме превращений:
С7Н8 ® С7Н7Br ® С7Н8O ® С7Н6O2 ® С7Н9O2N ® C14H10O4Ba ® С7Н5O2Na.
В уравнениях укажите структурные формулы веществ и условия протекания реакций.
9. Оксид неметалла массой 10.16 г добавили к 124 г 10.00%-ного раствора гидроксида натрия и получили раствор, в котором массовая доля соли равна 11.27%. Определите формулы оксида и соли. Рассчитайте массовую долю щелочи в конечном растворе.
10. Смесь двух изомеров, один из которых представляет собой гомолог анилина, а другой – гомолог пиридина, содержит 78.5% углерода по массе. Некоторое количество этой смеси может прореагировать с 1.21 л бромоводорода (объем измерен при 22 оС и нормальном давлении) или с 500 г 3.2%-ной бромной воды. Установите возможные структурные формулы компонентов смеси и рассчитайте их массовые доли.
Вариант BБ-2004-2
1. При гидролизе дипептида состава C12H16N2O5 образовалась аминокислота C9H11NO3. Определите молекулярную формулу второго продукта гидролиза.
2. Приведите по два примера соединений разных классов, в которых атом иода имеет минимальную и максимальную степень окисления.
3. Смесь азота и углекислого газа имеет плотность по водороду 18. К 100 л этой смеси добавили 100 л углекислого газа. Рассчитайте плотность по водороду конечной смеси.
4. Предложите способ получения этилацетата, используя только метан и неорганические соединения. Напишите уравнения реакций.
5. Сернистый газ объемом 14.56 л (н.у.) поглотили 200 г 17%-ного раствора гидроксида натрия. Определите, какие вещества содержатся в полученном растворе, и рассчитайте их массы.
6. Рассчитайте степень диссоциации сероводородной кислоты по первой ступени:
а) в 0.01 М растворе H2S;
б) в 0.01 М растворе H2S, содержащем 0.1 М HCl.
Константа диссоциации H2S по первой ступени: K 1 = 1.0×10–7.
7. Напишите уравнения химических реакций, соответствующие следующей схеме превращений:
MnO2 ® Mn ® Mn(NO3)2 ® MnO2 ® MnBr2 ® MnCl2 ® (CH3COO)2Mn.
8. Напишите уравнения химических реакций, соответствующие следующей схеме превращений:
C7H16 ® X ® C6H5COOH ® Y ® C6H5COONa ® Z ® C6H5NO2.
В уравнениях укажите структурные формулы веществ и условия протекания реакций.
9. Оксид неметалла массой 9.60 г добавили к 108 г 10.00%-ного раствора гидроксида натрия и получили раствор, в котором массовая доля соли равна 14.49%. Определите формулы оксида и соли. Рассчитайте массовую долю щелочи в конечном растворе.
10. Смесь двух изомеров, один из которых представляет собой гомолог анилина, а другой — гомолог пиридина, содержит 13.1% азота по массе. Некоторое количество этой смеси может прореагировать с 0.95 л хлороводорода (объем измерен при 16.5 оС и нормальном давлении) или с 320 г 4%-ной бромной воды. Установите возможные структурные формулы компонентов смеси и рассчитайте их массовые доли.
Вариант BБ-2004-3
1. При щелочном гидролизе сложного эфира состава C10H12O2 образовалась соль C3H5O2Na. Определите молекулярную формулу второго продукта гидролиза, если известно, что его молекула состоит из атомов трех элементов.
2. Приведите по два примера соединений разных классов, в которых атом селена имеет минимальную и максимальную степень окисления.
3. Смесь водорода и аммиака имеет плотность по водороду 3.5. К 80 л этой смеси добавили 120 л аммиака. Рассчитайте плотность по водороду конечной смеси.
4. Предложите способ получения диэтилового эфира, используя только метан и неорганические соединения. Напишите уравнения реакций.
5. Углекислый газ объемом 7.84 л (н.у.) поглотили 154 г 20%-ного раствора гидроксида калия. Определите, какие вещества содержатся в полученном растворе, и рассчитайте их массы.
6. Рассчитайте степень диссоциации уксусной кислоты: а) в 1 М растворе CH3COOH; б) в 1 М растворе CH3COOH, содержащем 1 М HCl. Константа диссоциации CH3COOH: K = 1.8×10–5.
7. Напишите уравнения химических реакций, соответствующие следующей схеме превращений:
Ag ® Ag2SO4 ® AgNO3 ® Ag2O ® AgF ® CH3COOAg ® Ag.
8. Напишите уравнения химических реакций, соответствующие следующей схеме превращений:
С8Н8 ® С8Н9Br ® С8Н10O ® С7Н6O2 ® C14H10O4Ba ® С7Н9O2N ® С7Н5O2Na.
В уравнениях укажите структурные формулы веществ и условия протекания реакций.
9. Оксид неметалла массой 7.62 г добавили к 125 г 13.44%-ного раствора гидроксида калия и получили раствор, в котором массовая доля соли равна 10.00%. Определите формулы оксида и соли. Рассчитайте массовую долю щелочи в конечном растворе.
10. Смесь двух изомеров, один из которых представляет собой гомолог анилина, а другой – гомолог пиридина, содержит 11.6% азота по массе. Некоторое количество этой смеси может прореагировать с 0.73 л хлороводорода (объем измерен при 24 оС и нормальном давлении) или с 240 г 4%-ной бромной воды. Установите возможные структурные формулы компонентов смеси и рассчитайте их массовые доли.
Вариант BБ-2004-4
1. При щелочном гидролизе сложного эфира состава C9H10O2 образовалась соль C2H3O2K. Определите молекулярную формулу второго продукта гидролиза, если известно, что его молекула состоит из атомов трех элементов.
2. Приведите по два примера соединений разных классов, в которых атом теллура имеет минимальную и максимальную степень окисления.
3. Смесь азота и углекислого газа имеет плотность по водороду 16. К 30 л этой смеси добавили 60 л углекислого газа. Рассчитайте плотность по водороду конечной смеси.
4. Предложите способ получения этаналя, используя только метан и неорганические соединения. Напишите уравнения реакций.
5. Сернистый газ объемом 19.04 л (н.у.) поглотили 250 г 17.6%-ного раствора гидроксида натрия. Определите, какие вещества содержатся в полученном растворе, и рассчитайте их массы.
6. Рассчитайте степень диссоциации хлорноватистой кислоты:
а) в 0.1 М растворе HClO;
б) в 0.1 М растворе HClO, содержащем 1 М HCl.
Константа диссоциации HClO: K = 2.8×10–8.
7. Напишите уравнения химических реакций, соответствующие следующей схеме превращений:
Cu2O ® CuSO4 ® Cu(OH)2 ® Cu2O ® [Cu(NH3)2]OH ® C3H3Cu. → CuCl.
8. Напишите уравнения химических реакций, соответствующие следующей схеме превращений:
C8H18 ® X ® C6H4(COOH)2 ® Y ® C6H4(COOK)2 ® Z ® C6H12.
В уравнениях укажите структурные формулы веществ и условия протекания реакций.
9. Оксид неметалла массой 10.40 г добавили к 180 г 17.50%-ного раствора гидроксида калия и получили раствор, в котором массовая доля соли равна 11.88%. Определите формулы оксида и соли. Рассчитайте массовую долю щелочи в конечном растворе.
10. Смесь двух изомеров, один из которых представляет собой гомолог анилина, а другой — гомолог пиридина, содержит 9.09% водорода по массе. Некоторое количество этой смеси может прореагировать с 1.45 л бромоводорода (объем измерен при 22 оС и нормальном давлении) или с 600 г 4%-ной бромной воды. Установите возможные структурные формулы компонентов смеси и рассчитайте их массовые доли.
Вариант MБ-2004-1
1. Каковы валентности и степени окисления элементов в молекулах Br2 и CH2Cl2?
2. Приведите уравнение реакции взаимодействия железа с горячей концентрированной серной кислотой.
3. Приведите структурную формулу простейшего алкена, который может существовать в виде двух оптических изомеров. Назовите это соединение.
4. Сравните основность анилина и п -нитроанилина. Ответ обоснуйте.
5. Полное омыление 40.3 г жира привело к образованию единственной калиевой соли карбоновой кислоты массой 44.1 г. Определите структурную формулу жира.
6. К 200 мл 0.15 М раствора HCl прилили 100 мл раствора NaOH с концентрацией 0.1 М. Определите рН полученного раствора. Какой объем раствора NaOН нужно было прилить для того, чтобы значение рН составило 12?
7. Предложите способ получения в несколько стадий п -аминобензойной кислоты из метана (не используя других органических реагентов). Приведите уравнения всех реакций и условия их протекания.
8. Приведите уравнения шести реакций, соответствующих следующей схеме превращений, укажите условия их протекания:
Cu2O → X → Cu(NO3)2 → Y → HNO3 → Z → Ag2O.
9. Три идентичных сосуда (равного объема и равной массы) содержат газы, находящиеся при одинаковых условиях. Первый сосуд, заполненный водородом, имеет массу 24.8 г. Масса второго, заполненного кислородом, составляет 36.8 г. Третий сосуд содержит смесь 40% (по объему) азота и неизвестного газа и имеет массу 33.28 г. Определите неизвестный газ.
10. Альдегид массой 23.2 г нагрели с 88.2 г свежеосажденного гидроксида меди (II). Образовавшийся осадок отделили и нагревали до постоянной массы, которая составила 65.6 г. Определите возможную структурную формулу неизвестного альдегида.
Вариант MБ-2004-2
1. Каковы валентности и степени окисления элементов в молекулах N2 и CHCl3?
2. Приведите уравнение реакции взаимодействия хлора с холодным раствором гидроксида калия.
3. Приведите структурную формулу простейшего нитроалкана, который может существовать в виде двух оптических изомеров. Назовите это соединение.
4. Сравните основность метиламина и п -метиланилина. Ответ обоснуйте.
5. Для полного омыления 35.6 г жира, образованного одной карбоновой кислотой, потребовалось 20 мл 20%-ного раствора гидроксида натрия с плотностью 1.2 г/мл. Определите структурную формулу жира.
6. К 100 мл раствора КОН с концентрацией 0.12 М прилили 100 мл раствора HBr с концентрацией 0.1 М. Определите рН полученного раствора. Какой объем раствора HBr нужно было прилить для того, чтобы значение рН составило 2?
7. Предложите способ получения в несколько стадий п -нитростирола из этилена (не используя других органических реагентов). Приведите уравнения всех реакций и условия их протекания.
8. Приведите уравнения шести реакций, соответствующих следующей схеме превращений, укажите условия их протекания:
(NH4)2Cr2O7 → X → NH3 → Y → H2O → Z → S.
9. Смесь порошка алюминия и карбоната кальция (масса смеси 20.8 г) сплавили в открытом тигле в атмосфере кислорода. Определите массовые доли веществ в полученной после сплавления смеси, если ее масса стала равна 26.0 г.
10. Альдегид массой 13.2 г нагрели с 68.6 г свежеосажденного гидроксида меди (II). Образовавшийся осадок отделили и нагревали до постоянной массы, которая составила 51.2 г. Определите возможную структурную формулу неизвестного альдегида.
Вариант MБ-2004-3
1. Каковы валентности и степени окисления элементов в молекулах О2 и CH3Cl?
2. Приведите уравнение реакции взаимодействия хрома с горячей концентрированной азотной кислотой.
3. Приведите структурную формулу простейшего алкина, который может существовать в виде двух оптических изомеров. Назовите это соединение.
4. Сравните кислотность п -метилфенола и п -хлорфенола. Ответ обоснуйте.
5. В результате полного омыления 17.68 г жира образовалась единственная соль карбоновой кислоты и 1.84 г глицерина. Определите структурную формулу жира.
6. К 100 мл 0.2 М раствора HCl прилили 150 мл раствора КОН с концентрацией 0.1 М. Определите рН полученного раствора. Какой объем раствора КОН нужно было прилить для того, чтобы значение рН составило 12?
7. Предложите способ получения в несколько стадий п -аминофенола из метана (не используя других органических реагентов). Приведите уравнения всех реакций и условия их протекания.
8. Приведите уравнения шести реакций, соответствующих следующей схеме превращений, укажите условия их протекания:
CaHPO4 → X → P → Y → H3PO4 → Z → HCl.
9. Три идентичных сосуда (равного объема и равной массы) содержат газы, находящиеся при одинаковых условиях. Первый сосуд, заполненный кислородом, имеет массу 33.45 г. Масса второго, заполненного гелием, составляет 27.85 г. Третий сосуд содержит смесь 20% (по объему) гелия и неизвестного газа и имеет массу 27.53 г. Определите неизвестный газ.
10. Альдегид массой 14.4 г нагрели с 49.0 г свежеосажденного гидроксида меди (II). Образовавшийся осадок отделили и нагревали до постоянной массы, которая составила 36.8 г. Определите возможную структурную формулу неизвестного альдегида.
Вариант MБ-2004-4
1. Каковы валентности и степени окисления элементов в молекулах I2 и H2CO?
2. Приведите уравнение реакции взаимодействия кремния с раствором гидроксида натрия.
3. Приведите структурную формулу простейшей аминокислоты, которая может существовать в виде двух оптических изомеров. Назовите это соединение.
4. Сравните основность п -хлоранилина и п -метиланилина. Ответ обоснуйте.
5. Полное омыление 26.34 г жира привело к образованию единственной натриевой соли карбоновой кислоты массой 27.18 г. Определите структурную формулу жира.
6. Предложите способ получения в несколько стадий п -гидроксибензилового спирта из метана (не используя других органических реагентов). Приведите уравнения всех реакций и условия их протекания.
7. К 200 мл 0.15 М раствора NaOH прилили 100 мл раствора HBr с концентрацией 0.1 М. Определите рН полученного раствора. Какой объем раствора HBr нужно было прилить для того, чтобы значение рН составило 3?
8. Приведите уравнения шести реакций, соответствующих следующей схеме превращений, укажите условия их протекания:
Fe → X → Fe(OH)2 → Y → Fe2O3 → Z → BaSO4 .
9. Смесь порошка цинка и карбоната бария (масса смеси 45.9 г) сплавили в открытом тигле в атмосфере кислорода. Определите массовые доли веществ в полученной после сплавления смеси, если ее масса стала равна 38.7 г.
10. Альдегид массой 23.2 г нагрели с 88.2 г свежеосажденного гидроксида меди (II). Образовавшийся осадок отделили и нагревали до постоянной массы, которая составила 65.6 г. Определите возможную структурную формулу неизвестного альдегида.
Вариант ББА-2004-1
1. Приведите пример межклассовой изомерии для аминокислот.
2. Природный хлор состоит из двух стабильных изотопов: 35Cl и 37Cl. Исходя из средней относительной атомной массы хлора, равной 35.45, рассчитайте изотопный состав хлора в процентах по массе.
3. Чему равна массовая доля азотной кислоты в водном растворе, в котором содержится одинаковое число атомов водорода и кислорода?
4. При полном разложении нитрата металла (степень окисления +1) масса твердого остатка составила 21.7% от массы исходного нитрата. Установите формулу нитрата и запишите уравнение его разложения.
5. Имеется смесь, состоящая из этилбензола, п -бромфенола и п -нитробензойной кислоты. Предложите оптимальный химический способ выделения из смеси каждого соединения в индивидуальном виде. Напишите уравнения соответствующих реакций.
6. При сжигании паров этанола в кислороде выделилось 494.2 кДж теплоты и осталось 19.7 л кислорода (измерено при давлении 101.3 кПа и температуре 27°С). Рассчитайте массовые доли компонентов в исходной смеси. Теплоты образования оксида углерода (IV), паров воды и паров этанола равны 393.5, 241.8 и 277.0 кДж/моль соответственно.
7. Напишите уравнения химических реакций, соответствующие следующей схеме:
HCl ® X1 ® KClO3 ® X2 ® K2SO4 ® KNO3 ® X3 ® KO2.
Укажите условия протекания реакций. Определите неизвестные вещества.
8. Напишите уравнения химических реакций, соответствующие следующей схеме:
C3H8O ® C3H6O2 ® X1 ® C5H10O ® X2 ® C6H14O ® C6H12.
Укажите условия протекания реакций. Определите неизвестные вещества.
9. Смесь азота и водорода имела плотность по водороду меньше 2. После пропускания смеси над нагретым катализатором и охлаждения образовался аммиак с выходом 20%, в результате чего плотность смеси по водороду стала больше 2. Определите области возможных объёмных долей азота в исходной и конечной смесях.
10. В результате взаимодействия 2.80 г смеси бутенов с раствором перманганата калия в присутствии серной кислоты образовалось 0.74 г пропионовой кислоты и выделилось 0.896 л (н. у.) углекислого газа. Какие углеродсодержащие соединения и в каком количестве были получены, если окисление прошло с количественным выходом? Каков качественный и количественный состав исходной смеси?
Вариант ББА-2004-2
1. Приведите пример межклассовой изомерии для алкенов.
2. Природное серебро состоит из двух стабильных изотопов: 107Ag и 109Ag. Исходя из средней относительной атомной массы серебра, равной 107.87, рассчитайте изотопный состав серебра в процентах по массе.
3. Чему равна массовая доля серной кислоты в водном растворе, в котором содержится одинаковое число атомов водорода и кислорода?
4. При полном разложении сульфата металла (степень окисления +2) масса твердого остатка составила 52.6% от массы исходного сульфата. Установите формулу сульфата и запишите уравнение его разложения.
5. Имеется смесь, состоящая из толуола, п -бромбензойной кислоты и п -аминобензойной кислоты. Предложите оптимальный химический способ выделения из смеси каждого соединения в индивидуальном виде. Напишите уравнения соответствующих реакций.
6. При сжигании паров этаналя в кислороде выделилось 441.8 кДж теплоты и осталось 14.9 л кислорода (измерено при давлении 102.1 кПа и температуре 32°С). Рассчитайте массовые доли компонентов в исходной смеси. Теплоты образования оксида углерода (IV), паров воды и паров этаналя равны 393.5, 241.8 и 166.2 кДж/моль соответственно.
7. Напишите уравнения химических реакций, соответствующие следующей схеме:
KNO3 → X1 → CuO → X2 → CuCl2→ HCl → X3 ® FeCl.
Укажите условия протекания реакций. Определите неизвестные вещества.
8. Напишите уравнения химических реакций, соответствующие следующей схеме:
C6H12 ® C3H6O ® C3H8O ® X1 ® C3H7MgBr ® X2 ® C4H8O2.
Укажите условия протекания реакций. Определите неизвестные вещества.
9. Смесь азота и водорода имела плотность по водороду меньше 3. После пропускания смеси над нагретым катализатором и охлаждения образовался аммиак с выходом 30%, в результате чего плотность смеси по водороду стала больше 3. Определите области возможных объёмных долей азота в исходной и конечной смесях.
10. В результате взаимодействия 2.24 г смеси бутенов с раствором перманганата калия в присутствии серной кислоты образовалось 0.58 г ацетона и 2.4 г уксусной кислоты. Какие углеродсодержащие соединения и в каком количестве были получены, если окисление прошло с количественным выходом? Каков качественный и количественный состав исходной смеси?
Вариант ББА-2004-3
1. Приведите пример межклассовой изомерии для карбоновых кислот.
2. Природная медь состоит из двух стабильных изотопов: 63Cu и 65Cu. Исходя из средней относительной атомной массы меди, равной 63.55, рассчитайте изотопный состав меди в процентах по массе.
3. Чему равна массовая доля фосфорной кислоты в водном растворе, в котором содержится одинаковое число атомов водорода и кислорода?
4. При полном разложении нитрата металла (степень окисления +1) масса твердого остатка составила 63.5% от массы исходного нитрата. Установите формулу нитрата и запишите уравнение его разложения.
5. Имеется смесь, состоящая из бензола, п -аминофенола и п -аминобензойной кислоты. Предложите оптимальный химический способ выделения из смеси каждого соединения в индивидуальном виде. Напишите уравнения соответствующих реакций.
6. При сжигании паров диметилового эфира в кислороде выделилось 398.5 кДж теплоты и осталось 13.7 л кислорода (измерено при давлении 100.1 кПа и температуре 27°С). Рассчитайте массовые доли компонентов в исходной смеси. Теплоты образования оксида углерода (IV), паров воды и паров диметилового эфира равны 393.5, 241.8 и 184.1 кДж/моль соответственно.
7. Напишите уравнения химических реакций, соответствующие следующей схеме:
Na2S → X1 → SO2 → X2 → H2SO4 → SO2 → X3 ® HgS.
Укажите условия протекания реакций. Определите неизвестные вещества.
8. Напишите уравнения химических реакций, соответствующие следующей схеме:
C2H6O ® C2H4O2 ® X1 ® C3H6O ® X2 ® C5H12O ® C5H10.
Укажите условия протекания реакций. Определите неизвестные вещества.
9. Смесь азота и водорода имела плотность по водороду меньше 4. После пропускания смеси над нагретым катализатором и охлаждения образовался аммиак с выходом 40%, в результате чего плотность смеси по водороду стала больше 4. Определите области возможных объёмных долей азота в исходной и конечной смесях.
10. В результате взаимодействия 3.36 г смеси бутенов с раствором перманганата калия в присутствии серной кислоты образовалось 3.6 г уксусной и 0.74 г пропионовой кислот. Какие углеродсодержащие соединения и в каком количестве были получены, если окисление прошло с количественным выходом? Каков качественный и количественный состав исходной смеси?
Вариант ББА-2004-4
1. Приведите пример межклассовой изомерии для альдегидов.
2. Природный бром состоит из двух стабильных изотопов: 79Br и 81Br. Исходя из средней относительной атомной массы брома, равной 79.90, рассчитайте изотопный состав брома в процентах по массе.
3. Чему равна массовая доля хлорной кислоты в водном растворе, в котором содержится одинаковое число атомов водорода и кислорода?
4. При полном разложении нитрата металла (степень окисления +2) масса твердого остатка составила 44.4% от массы исходного нитрата. Установите формулу нитрата и запишите уравнение его разложения.
5. Имеется смесь, состоящая из толуола, п -хлорфенола и п -аминобензойной кислоты. Предложите оптимальный химический способ выделения из смеси каждого соединения в индивидуальном виде. Напишите уравнения соответствующих реакций.
6. При сжигании паров ацетона в кислороде выделилось 506.5 кДж теплоты и осталось 12.1 л кислорода (измерено при давлении 103.8 кПа и температуре 29°С). Рассчитайте массовые доли компонентов в исходной смеси. Теплоты образования оксида углерода (IV), паров воды и паров ацетона равны 393.5, 241.8 и 217.6 кДж/моль соответственно.
7. Напишите уравнения химических реакций, соответствующие следующей схеме:
HNO3 → X1 → NO2 → X2 → N2 → NH3 → X3 ® NaCl.
Укажите условия протекания реакций. Определите неизвестные вещества.
8. Напишите уравнения химических реакций, соответствующие следующей схеме:
C4H6 ® C4H8O ® X1 ® C5H12O ® X2 ® C5H10 ® C3H6O.
Укажите условия протекания реакций. Определите неизвестные вещества.
9. Смесь азота и водорода имела плотность по водороду меньше 5. После пропускания смеси над нагретым катализатором и охлаждения образовался аммиак с выходом 50%, в результате чего плотность смеси по водороду стала больше 5. Определите области возможных объёмных долей азота в исходной и конечной смесях.
10. В результате взаимодействия 3.92 г смеси бутенов с раствором перманганата калия в присутствии серной кислоты образовалось 0.74 г пропионовой кислоты и 2.32 г ацетона. Какие углеродсодержащие соединения и в каком количестве были получены, если окисление прошло с количественным выходом? Каков качественный и количественный состав исходной смеси?
Вариант ПА–2004–1
1. Сгруппируйте атомы в следующих брутто-формулах веществ таким образом, чтобы можно было отнести данное соединение к определенному классу:
а) Cu2H2O5C; б) Na2SH20O14.
2. Расположите в порядке возрастания рН 0.1М растворы следующих веществ:
HCl, NaOH, K2CO3, AlCl3, NaNO3.
3. Напишите два уравнения реакций с участием хлора, одна из которых является реакцией радикального замещения (SR), а вторая – электрофильного присоединения (AE).
4. Природный кремний состоит из 3.1% (по молям) изотопа 30Si (с атомной массой 29.9738), а также из изотопов 29Si (с атомной массой 28.9765) и 28Si (с атомной массой 27.9770). Рассчитайте содержание в % (по молям) 29Si и 28Si.
5. Запишите выражения для констант равновесия следующих процессов:
а) CaO(тв) + CO2(г) ⇄ CaCO3(тв);
б) 2NH3 (г) ⇄ 3H2(г) + N2(г).
6. Напишите уравнения реакций, соответствующих следующей схеме:

Определите неизвестные вещества А и Б.
7. Рассчитайте массу нитрата железа (II), которую необходимо взять, чтобы в выделенном при его термическом разложении кислороде сгорело 11.1 г цитозина.
8. Напишите уравнения реакций, соответствующих следующей схеме. Определите неизвестные вещества Х 1 – Х 6.
9. Для получения водорода используется реакция углерода с перегретым водяным паром. Теплота, необходимая для этой реакции, обеспечивается горением углерода. Рассчитайте массу углерода, которая требуется для получения 10 г водорода. Теплоты образования СО2, СО и Н2О равны 394, 111 и 242 кДж/моль соответственно.
10. К раствору, образовавшемуся при действии 89.3 мл 39.2%-ного раствора серной кислоты (с плотностью1.4 г/см3) на 20.6 г гидроксида хрома (III), прибавили 225 г 33.85%-ного раствора сульфида бария. Образовавшуюся смесь слегка нагрели до окончания реакций. Вычислите массовые доли веществ, содержащихся в растворе после окончания опыта.
Вариант ПА–2004–2
1. Сгруппируйте атомы в следующих брутто-формулах веществ таким образом, чтобы можно было отнести данное соединение к определенному классу:
а) CuSH10O9 б) C6FeN6K3.
2. Расположите в порядке возрастания рН 0.1М растворы следующих веществ: HNO3, NaCl, CuSO4, NaHCO3, KOH.
3. Напишите два уравнения реакций с участием хлора, одна из которых является реакцией электрофильного замещения (SE), а вторая – электрофильного присоединения (AE).
4. Природный магний состоит из 78.99% (по молям) изотопа 24Mg (с атомной массой 23.9850), а также из изотопов 25Mg (с атомной массой 24.9858) и 26Mg (с атомной массой 25.9826). Рассчитайте содержание в % (по молям) 25Mg и 26Mg.
5. Запишите выражения для констант равновесия следующих процессов:
а) MgO(тв) + CO2(г) ⇄ MgCO3(тв);
б) 2H2O(г) ⇄ 2H2 (г) + O2 (г).
6. Напишите уравнения реакций, соответствующих следующей схеме:

Определите неизвестные вещества А и Б.
7. Рассчитайте массу перманганата калия, которую необходимо взять, чтобы в выделившемся при его термическом разложении кислороде сгорело 13.5 г аденина.
8. Напишите уравнения реакций, соответствующих следующей схеме. Определите неизвестные вещества Х 1 – Х 6.

9. Для получения меди используется реакция оксида меди с углеродом. Теплота, необходимая для этой реакции, обеспечивается горением углерода. Рассчитайте массу углерода, которая требуется для получения 127 г меди. Теплоты образования СО2, СО и CuО равны 394, 111 и 162 кДж/моль соответственно.
10. К раствору, образовавшемуся при действии 35.7 мл 39.2%-ного раствора серной кислоты (с плотностью 1.4 г/см3) на 8.125 г цинка, прибавили 75 г 33.8%-ного раствора сульфида бария. Образовавшуюся смесь слегка нагрели до окончания реакций. Вычислите массовые доли веществ, содержащихся в растворе после окончания опыта.
Вариант ПА–2004–3
1. Сгруппируйте атомы в следующих брутто-формулах веществ таким образом, чтобы можно было отнести данное соединение к определенному классу:
а) Al2SH4O8; б) СuH12N4Cl2.
2. Расположите в порядке возрастания рН 0.1М растворы следующих веществ: CH3COOK, KOH, Zn(NO3)2, HCl, CsBr.
3. Напишите два уравнения реакций с участием бромоводорода, одна из которых является реакцией нуклеофильного замещения (SN), а вторая – электрофильного присоединения (AE).
4. Природный неон состоит из 9.215 % (по молям) изотопа 22Ne (с атомной массой 21.9914), а также из изотопов 21Ne (с атомной массой 20.9938) и 20Ne (с атомной массой 19.9924). Рассчитайте содержание в % (по молям) 21Ne и 20Ne.
5. Запишите выражения для констант равновесия следующих процессов:
а) CaCO3 (тв) ⇄CaO(тв) + CO2(г);
б) N2O4(г) ⇄ 2NO2(г).
6. Напишите уравнения реакций, соответствующих следующей схеме:
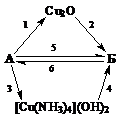
Определите неизвестные вещества А и Б.
7. Рассчитайте массу дихромата калия, которую необходимо взять, чтобы в выделившемся при его термическом разложении кислороде сгорело 12.6 г тимина.
8. Напишите уравнения реакций, соответствующих следующей схеме. Определите неизвестные вещества Х 1 – Х 6.
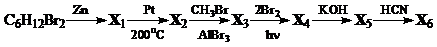
9. Для получения железа используется реакция оксида железа (II) с углеродом. Теплота, необходимая для этой реакции, обеспечивается горением углерода. Рассчитайте массу углерода, которая потребуется для получения 112 г железа. Теплоты образования СО2, СО и FeО равны 394, 111 и 265 кДж/моль соответственно.
10. К раствору, образовавшемуся при действии 178.6 мл 39.2%-ного раствора серной кислоты (с плотностью 1.4 г/см3) на 20.4 г оксида алюминия, прибавили 450 г 33.8%-ного раствора сульфида бария. Образовавшуюся смесь слегка нагрели до окончания реакций. Вычислите массовые доли веществ, содержащихся в растворе после окончания опыта.
Вариант ПА–2004–4
1. Сгруппируйте атомы в следующих брутто-формулах веществ таким образом, чтобы можно было отнести данное соединение к определенному классу:
а) AgN3H6O3; б) Na2CH20O13 .
2. Расположите в порядке возрастания рН 0.1М растворы следующих веществ: Fe2(SO4)3, CsOH, Na2SiO3, KNO3, HI.
3. Напишите два уравнения реакций, в одной из которых гидроксид натрия является нуклеофилом, а в другой – основанием.
4. Природный кислород состоит из 0.2% (по молям) изотопа 18О (с атомной массой 17.9992), а также из изотопов 17О (с атомной массой 16.9993) и 16О (с атомной массой 15.9949). Рассчитайте содержание в % (по молям) 17О и 16О.
5. Запишите выражения для констант равновесия следующих процессов:
а) H2(г) + I2(тв) ⇄ 2HI(г);
б) СО(г)+ Сl2(г) ⇄ COCl2(г) .
6. Напишите уравнения реакций, соответствующих следующей схеме:
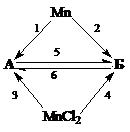
Определите неизвестные вещества А и Б.
7. Рассчитайте массу нитрата серебра, которую необходимо взять, чтобы в выделившемся при его термическом разложении кислороде сгорело 11.2 г урацила.
8. Напишите уравнения реакций, соответствующих следующей схеме. Определите неизвестные вещества Х 1 – Х 6.
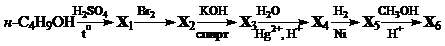
9. Для получения свинца используется реакция оксида свинца (II) с углеродом. Теплота, необходимая для этой реакции, обеспечивается горением углерода. Рассчитайте массу углерода, которая требуется для получения 103.5 г свинца. Теплоты образования СО2, СО и PbО равны 394, 111 и 218 кДж/моль соответственно.
10. К раствору, образовавшемуся при действии 71.4 мл 39.2 %-ного раствора серной кислоты (с плотностью 1.4 г/см3) на 14 г железа, прибавили 150 г 33.8%-ного раствора сульфида бария. Образовавшуюся смесь слегка нагрели до окончания реакций. Вычислите массовые доли веществ, содержащихся в растворе после окончания опыта.
Вариант HMB-2004-1
1. Напишите электронную конфигурацию а
 2018-01-21
2018-01-21 4646
4646








