Электропроводность чистой, тщательно дистиллированной воды близка к нулю и возрастает по мере повышения концентрации растворенных в ней веществ.
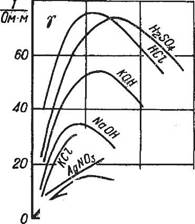
З 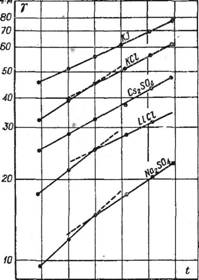 ависимость электропроводности растворов от температуры.
ависимость электропроводности растворов от температуры.
Подвижность ионов сильно зависит от температуры раствора, и поэтому с увеличением температуры электропроводность возрастает.
30.
Прямая кондуктометрия – метод, позволяющий определять концентрацию электролита путем измерения электропроводности раствоа.
Достоинства прямой кондуктометрии: простота эксперимента; высокая чувствительность (до ~10-4 моль/л); сравнительно малая погрешность определения (0,1-2%).
Недостатки прямой кондуктометрии: электропроводность – величина аддитивная и дает информацию об общей концентрации ионов в растворе; малая селективность метода.
Применение прямой кондуктометрии в анализе: для контроля качества дистиллированной воды и жидких пищевых продуктов (молока, напитков и др.); для определения общего содержания солей в минеральной, морской, речной воде; для определения растворимости малорастворимых электролитов; для исследования кинетики химических реакций и расчета констант равновесия.
Достоинства кондуктометрического титрования:
- титрование можно проводить в мутных, окрашенных, непрозрачных средах;
- высокая чувствительность и малая погрешность определения;
- анализ можно автоматизировать.
Недостатки кондуктометрического титрования:
относится малая селективность.
Применение кондуктометрического титрования: - титрование сильных и слабых кислот, оснований, аминов в широком диапазоне концентраций;
определение многих катионов (Fе3+, Сu2+, Ni2 и др.) и анионов (Cl-, Br-, I-, оксалат, тартрат, салицилат и др.), общей жесткости
- Высокочастотное кондуктометрическое титрование.
31.
Кондуктометрическое титрование – метод анализа, основанный на определении содержания вещества по излому кривой титрования. Кривую строят по измерениям удельной электропроводности раствора, меняющейся в результате химических реакций в процессе титрования.
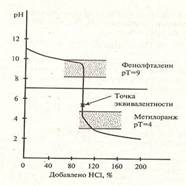
Кривая титрования – это график зависимости рН среды в колбе от объема добавленного титранта. Кривая титрования характеризуется точкой эквивалентности, точкой нейтральности, скачком титрования, линией нейтральности.
Кривые титрования — кривые, показывающие изменение концентраций веществ в процессе прохождения химических и электрохимических реакций титрования.
значение:
• дают возможность обнаружить, в какой мере та или иная реакция проходит количественно, т.е. можно ли ее использовать для титрования (оценка целесообразности титрования);
• дают возможность установить, за изменениями какой величины лучше всего следить в ходе титрования, как эта величина изменяется и как можно обнаружить конец титрования;
• дают возможность найти точку эквивалентности;
• дают возможность подобрать подходящий индикатор.
Построение кривой титрования.
Расчет начинается с определения рН исходного титруемого раствора. Сильные кислоты в водном растворе диссоциированы нацело, поэтому концентрация ионов Н+ будет равна концентрации кислоты (НА).
рН = -lgсНА
Значения рН раствора до точки эквивалентности будут определяться концентрацией неоттитрованной кислоты, так как все добавляемые ионы ОН- будут связываться.
В точке эквивалентности в системе находится соль и вода, поэтому рН раствора определяется ионным произведением воды, т.е. рН 7. После точки эквивалентности рН среды определяется концентрацией добавленной щелочи: рН = 14 – рОН = 14 + lgсМОН

Рис.1 титрование сильной кислотой сильным основанием.
Требования к индикаторам в методе нейтрализации:
1. резкое отличие в окраске двух форм индикатора в небольшом интервале рН, при добавлении малого количества гидроксид-ионов или протонов Н+;
2. изменение окраски должно быть обратимо; видимая окраска индикатора наблюдается лишь внутри интервала перехода окраски.
Выбор индикаторов в методе нейтрализации
| Условия титрования | рН в момент эквивалентности | Индикатор |
| сильную кислоту титруют сильным основанием | метиловый оранжевый, метиловый красный, фенолфталеин | |
| сильное основание титруют сильной кислотой | То же | |
| слабую кислоту титруют сильным основанием | больше 7 (слабощелочная) | фенолфталеин |
| Слабое основание титруют сильной кислотой | меньше 7 (слабокислая) | метиловый оранжевый, метиловый красный |
дифиринцированного титрования – это метод титрования при котором используется дифференцирующие растворители.
Дифференцирующее действие растворителя проявляется в увеличении различий в силе растворенных в нем протолитов. Такие растворители используют для раздельного титрования смесей кислот или оснований, поскольку различия в показателях констант кислотности или основности веществ, растворенных в подобных растворителях, возрастают по сравнению с водными растворами, вследствие чего становится возможным их раздельное титрование.
Так, в водном растворе хлорная и хлороводородная кислоты — сильные. В растворе же безводной уксусной кислоты они становятся слабыми с различной силой: для HClO4 Ka ≈ 10-4; для HCl Ka ≈ 10-7.
В безводной уксусной кислоте сила неорганических кислот понижается в следующей последовательности: НСlO4>HBr>H2SO4>HCl>HNO3. Наиболее сильной кислотой является хлорная кислота, наиболее слабой — азотная. Поэтому при проведении титрования оснований в среде безводной уксусной кислоты в качестве титранта предпочитают выбирать раствор хлорной кислоты как наиболее сильной
Титрование слабой кислоты сильным основанием. Например, CH3COOH(водн.) + NaOH(водн) -> CH3COONa(водн.) + H2O(ж.)
Вертикальная часть кривой этого титрования приходится на область значений рН от 6,5 до 11. Следовательно, удобными индикаторами для него оказываются феноловый красный либо фенолфталеин. Индикаторы с диапазоном изменения окраски, расположенным ниже рН 6, как у метилового оранжевого, не подходят для такого титрования,
Кривая титрования слабой кислоты сильным основанием:
В начальной точке кривой титрования рН раствора будет определяться диссоциацией слабой кислоты. Если титруется уксусная кислота, то рН в водном растворе будет определяться равновесием:
СН3СООН + Н2О <=> СН3СОО- + Н3О+ или СН3СООН=СН3СОО- + Н+
рН = 1/2рКкисл – 1/2lgскисл
для 0,1 М раствора уксусной кислоты рН = ½(4,76 + 1) = 2,88
При добавлении к раствору СН3СООН сильного основания (NaOH) в результате реакции появится эквивалентное количество ацетат-иона, который в смеси с уксусной кислотой образует ацетатный буферный раствор. Концентрация ионов водорода (или рН) до точки эквивалентности рассчитывается по формуле:
рН = рКкисл – lgcкисл + lgссоли
Для расчета участка кривой титрования 100 мл 0,1 М СН3СООН до точки эквивалентности задаемся несколькими объемами щелочи (0,10 М NaOH).
 2018-01-21
2018-01-21 1194
1194