Кривые титрования многопротонных кислот
Титрование многопротонных кислот сильными основаниями
может проходить в один или несколько этапов с получением одной
или нескольких точек эквивалентности и скачков на кривой
титрования в зависимости от числа протонов и соответствующих
ступенчатых констант ионизации кислоты. Чтобы получить две
отчетливые точки эквивалентности с хорошо выраженными
эквивалентными частями на кривых при титровании
двухпротонной кислоты Н2А необходимо соблюдение следующих
условий:
1. Значения KM и Кад должны быть достаточно велики, чтобы
выполнялось соотношение Ka-ca
2. Обе константы должны в достаточной степени различаться,
чтобы выполнялось соотношение Ка‚1:Ка‚2 ≥ 1-104 (или в
логарифмической форме АрК = рКад - рКад ≥ 4). B противном
случае титрование второго протона начнется до того, как
закончится титрование первого, и на кривой не будет двух точек
эквивалентности.
Концентрацию Н+ и величину рН исходного раствора кислоты
рассчитывают, исходя из формулы [H+] = 1/Ка‚1-сН„А. Значение
[H+] до точки эквивалентности вычисляют по уравнению
Гендерсона-Гассельбаха [H+] = К ад CH-ZA. Отношение CH-ZA
сНА_/ сНА_
рассчитывают также, как и при титровании слабой кислоты НА
с(Н2А)\2(Н2А) - cbvb
CHA_ cbvb
Затем находят значение рН в первой точке эквивалентности.
К этому моменту реакция прошла согласно уравнению Н2А + ОН-
HA‘ + H20, т.е. образуется кислая соль типа КгНА, которая в
водном растворе проявляет амфипротонные свойства. Поэтому в
первом приближении [H+] и рН можно вычислить по формулам
[H+] = V Ka,1 ⋅ Ka,2 И ⋮ %(pKa,l ⊹ pKa,2)'
После первой точки эквивалентности начинается реакция
НА” + OH‘ ≺−≻ ∆⊋− + H20.
Таким образом, до тех пор, пока не достигнута вторая точка
эквивалентности, в системе будет присутствовать кислота HA‘ и
её сопряжённое основание А}. Значение [H+] B этих условиях также
вычисляют по уравнению Гендерсона-Гассельбаха для буферного
раствора [H+] = Ка2 L.
СА2_
А рН во 2-й точке эквивалентности - по уравнению,
аналогичному для случая титрования слабой однопротонной
кислоты
pH = 7 + 1/2рКад + 1/21gcA2‘,
32.
Сущность потенциометрических методов анализа заключается в измерении (или регистрации изменения) электрохимического потенциала электрода, опущенного в исследуемый раствор, и нахождении концентрации потенциалопределяющих ионов. Зависимость между величиной этого потенциала и концентрацией потенциалопределяющих ионов в анализируемой среде описывается уравнением Нернста (Вальтер Нернст (1864 - 1941) - немецкий ученый):
 (4)
(4)
где Е – потенциал электрода
E0- стандартный потенциал редокс - пары
R - универсальная газовая постоянная, равная 8,312 Дж/(моль К)
T - абсолютная температура, К
F - постоянная Фарадея, равная 96485 Кл/моль
n - число электронов, принимающих участие в электродной реакции
[Ox], [Red] - равновесные концентрации окисленной и восстановленной форм редокс – пары, соответственно
Подставив значения R, T, F, учитывая коэффициент перехода от натуральных логарифмов к десятичным 2.303, получим уравнение Нернста в следующем виде:
 (5)
(5)
Потенциометрические методы анализа подразделяются на прямые и косвенные.
Прямая потенциометрия (потенциометрическое исследование) основана на непосредственном использовании уравнения Нернста для нахождения концентрации (Сх) потенциалобразующего иона в растворе по экспериментально измеренной величине Е - электродвижущей силе (ЭДС) цепи: E = f (Cx).
Потенциометрическое исследование используется для решения различных аналитических задач, при изучении электродвижущих сил химических источников тока, коэффициентов активности компонентов, констант равновесия химических реакций.
Потенциометрическое титрование (косвенная потенциометрия) основано на построении зависимости электродного потенциала (Е) от объема титранта (Vтитр.), добавляемого к раствору анализируемой пробы – Е = f(Vтитр.). Конец титрования соответствует резкому изменению величины электродного потенциала. Метод потенциометрического титрования широко используется для решения научно-исследовательских и производственных аналитических задач определения состава веществ и материалов металлургического производства.
Характерной особенностью потенциометрических методов анализа является их высокая избирательность, что создает возможность анализа сложных многокомпонентных смесей. С помощью потенциометрических методов анализа можно проводить одновременное определение нескольких совместно присутствующих ионов, что значительно сокращает время, затрачиваемое на анализ. Этот метод удобен в производственном контроле сложных по составу объектах. Возможности потенциометрических методов анализа значительно расширяются с применением органических титрантов, которые характеризуются высокой специфичностью. Это особенно ценно при определении ионов металлов при их совместном присутствии. Кроме того, потенциометрическое титрование и потенциометрическое исследование той или иной аналитической реакции могут быть проведены в окрашенных и мутных средах с высокой точностью и объективностью определения конечной точки титрования.
33.
34+35.
Фотометрический метод анализа основан на измерении интенсивности светового потока,прошедшего через анализируемый раствор. Основным законом фотометрии является закон Ламберта-Бугера_Бера:  , где
, где  – интенсивность падающего и прошедшего через раствор света соответственно, Лм; 10-основание десятичного логарифма; -молярный коэффициент ослабления,
– интенсивность падающего и прошедшего через раствор света соответственно, Лм; 10-основание десятичного логарифма; -молярный коэффициент ослабления,  ; С_концентрация раствора, моль/
; С_концентрация раствора, моль/  ;
;  – толщина слоя поглощающего раствора, см.
– толщина слоя поглощающего раствора, см.
Смысл закона Ламберт-Бугера-Бера можно выразить следующим образом. Одинаковые слои одного и того же вещества поглощает свет в одинаковой степени в независимости от интенсивности падающего на них светового потока.
Абсорбция:  . Абсорбция раствора прямо пропорциональна концентрации анализируемого вещества и толщине слоя раствора.
. Абсорбция раствора прямо пропорциональна концентрации анализируемого вещества и толщине слоя раствора.
Существует два метода фотометрического анализа:
1)Прямой фотометрический анализ.
Метод основан на определении концентрации анализируемого вещества по закону Д-Б-Г. Аналитическим сигналом в этом методе является либо абсорбция, либо светопропускание растворов.
Если вещество окрашено, то анализ проводят по методу собственного поглощения. В основном этот метод применяется для определения красителей или их смесей. В последнем случае при расчете концентраций отдельных компонентов смеси используют закон аддитивности абсорбций:
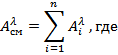
 -абсорбция смеси невзаимодействующих красителей на аналитической длине волны;
-абсорбция смеси невзаимодействующих красителей на аналитической длине волны;
 - абсорбции отдельных красителей, измеренные на той же длине волны и в тех же кюветах, что и абсорбция смеси.
- абсорбции отдельных красителей, измеренные на той же длине волны и в тех же кюветах, что и абсорбция смеси.
Абсорбция (светопропускание) анализируемых растворов измеряется на фотометрах или колориметрах. При измерении абсорбции используется относительный метод, который позволяет исключить поглощение света растворителем и учесть спектральные характеристики источников и приемников излучения.
2)Косвенный метод – фотометрическое титрование.
Фотометрическое титрование - \то титриметрический метод анализа, в котором точка эквивалентности определяется по резкому изменению абсорбции в ходе титрования.В фотометрическом титровании используются реакции нейтрализации, осаждения, окислительно-восстановительные и комплексо-образования. Метод позволяет проводить титрование по собственному поглощению и с помощью реагентов, в качестве последних могут использоваться индикаторы.

Где 1-источник видимого излучения;2-конденсор- система линз, собирающих лучи в одной точке;3-вхоная щель;4-коллиматор – система линз, направляющая параллельный пучок света на кювету;5-тепловой фильтр;6-сменные светофильтры(от 3 до 11);7,7”- кюветы с раствором сравнения и анализируемым раствором соответсвенно;8-светокомпенсатор(серые фильтры);9-фотоэлемент – преобразует световую энергию в электрическую; 10-усилитель;11-измерительный прибор, шкала котрого отградуирована в единицах абсорбции и светопропускания.
36.
А=𝜀cl
А(абсорбция)-на фотоколориметре
1.Метод коэф. экстинкции 


(таблица либо расчет по станд. р-ру)
Метод двух р-ров

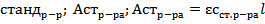

 =
= 
 2018-01-21
2018-01-21 726
726








