 |
Константа равновесия (К) –мера глубины протекания процесса (степени превращения исходных веществ в конечные)
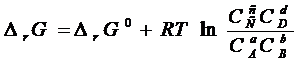 | |||||
| |||||
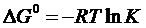 | |||||
РЕШЕНИЕ
Для расчета ЭДС необходимо рассчитать потенциалы электродов по уравнению Нернста: 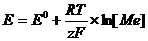 ,где E0 – стандартный потенциал металла, В; R – универсальная газовая постоянная, 8,31Дж/моль×К; T – температура, 298 К, К; z – число электронов, принимающих участие в электродной реакции; F – число Фарадея, 96500 Кл/моль; [Ме] – концентрация катионов металла, моль/л.
,где E0 – стандартный потенциал металла, В; R – универсальная газовая постоянная, 8,31Дж/моль×К; T – температура, 298 К, К; z – число электронов, принимающих участие в электродной реакции; F – число Фарадея, 96500 Кл/моль; [Ме] – концентрация катионов металла, моль/л.
Вычислим потенциалы электродов при заданных условиях:
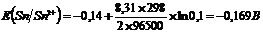
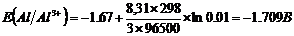
Электрод с меньшим равновесным потенциалом – анод, с большим – катод. Рассчитаем ЭДС гальванического элемента, как разность потенциалов электродов: 
Схема гальванического элемента:
 |
Анод (+) Al | Al2(SO4)3 (0,01 M) || SnCl2 (0,1 M)|Sn (-) Катод
Движение электронов во внешней цепи – от анода к катоду, направление электрического тока – противоположное.
Катодный и анодный процессы в этом гальваническом элементе можно представить в виде уравнений реакций:
Анод: Al → Al3+ + 3e |3| 2 - окисление
Катод: Sn2+ + 2e → Sn|2| 3 - восстановление
2Al + 3Sn2+→ 2Al3+ + 3Sn
Суммарное уравнение реакции:
2Al + 3SnCl2 → 2AlCl3 + 3Sn
 2018-01-21
2018-01-21 405
405








