1. Взаимодействие кислоты с недостатком основания. KOH + H2SO4 ® KHSO4 + H2O
2. Взаимодействие основания с избытком кислотного оксида Ca(OH)2 + 2CO2 ® Ca(HCO3)2
3. Взаимодействие средней соли с кислотой Ca3(PO4)2 + 4H3PO4 ® 3Ca(H2PO4)2
Химические свойства.
1. Термическое разложение с образованием средней соли Ca(HCO3)2 ® CaCO3¯ + CO2 + H2O
2. Взаимодействие со щёлочью. Получение средней соли. Ba(HCO3)2 + Ba(OH)2 ® 2BaCO3¯ + 2H2O
Основные соли Получение
1. Гидролиз солей, образованных слабым основанием и сильной кислотой
ZnCl2 + H2O ® [Zn(OH)]Cl + HCl
2. Добавление (по каплям) небольших количеств щелочей к растворам средних солей металлов
AlCl3 + 2NaOH ® [Al(OH)2]Cl + 2NaCl
3. Взаимодействие солей слабых кислот со средними солями
2MgCl2 + 2Na2CO3 + H2O ® [Mg(OH)]2CO3¯ + CO2 + 4NaCl
Химические свойства.
1. Термическое разложение. [Cu(OH)]2CO3(малахит) ® 2CuO + CO2 + H2O
2. Взаимодействие с кислотой: образование средней соли. Sn(OH)Cl + HCl «SnCl2 + H2O
В 32
Комплексные соли Строение
| K4[Fe(CN)6] | |
| K4[Fe(CN)6] | – Внешняя сфера |
| K4[Fe(CN)6] | – Внутренняя сфера |
| K4[Fe(CN)6] | – Комплексообразователь (центральный атом) |
| K4[Fe(CN)6] | – Координационное число |
| K4[Fe(CN)6] | – Лиганд |
Центральными атомами обычно служат ионы металлов больших периодов (Co, Ni, Pt, Hg, Ag, Cu); типичными лигандами являются OH-, CN-, NH3, CO, H2O; они связаны с центральным атомом донорно-акцепторной связью.
Получение
1. Реакции солей с лигандами: AgCl + 2NH3 ® [Ag(NH3)2]Cl FeCl3 + 6KCN ® K3[Fe(CN)6] + 3KCl
Химические свойства.
1. Разрушение комплексов за счёт образования малорастворимых соединений:
2[Cu(NH3)2]Cl + K2S ® CuS¯ + 2KCl + 4NH3
2. Обмен лигандами между внешней и внутренней сферами.
K2[CoCl4] + 6H2O ® [Co(H2O)6]Cl2 + 2KCl
В 22
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Степень окисления
Степень окисления - это условный заряд атома в молекуле, вычисленный в предположении, что молекула состоит из ионов и в целом электронейтральна.
Наиболее электроотрицательные элементы в соединении имеют отрицательные степени окисления, а атомы элементов с меньшей электроотрицательностью - положительные.
Степень окисления - формальное понятие; в ряде случаев степень окисления не совпадает с валентностью.
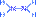 Например:
Например:
N2H4 (гидразин)
степень окисления азота – -2; валентность азота – 3.
 2018-01-21
2018-01-21 908
908








