Химические источники электрической энергии. Мы уже зна-ем, что при любой окислительно-восстановительной реакции происходит пере-ход электронов от восстановителя κ окислителю. Так, при опускании цинковой пластинки в раствор сульфата меди происходит реакция
Zn+ Cu2+ = Cu+ Zn2+..
Здесь восстановитель — цинк — отдает электроны. Эта полуреакция выража-ется уравнением:
Zn - 2е -= Zn2+.
Окислитель — ион меди — принимает электроны. Уравнение этой полуреак-ции имеет вид:
Cu2+ + 2е- = Cu.
B рассматриваемом примере обе полуреакции протекают в месте соприкос-новения цинка с раствором, так что электроны непосредственно переходят от атомов цинка κ ионам меди. Можно, однако, осуществить эту реакцию таким способом, что окислительная и восстановительная полуреакции окажутся про-странственно разделенными, а электроны будут переходить от восстановителя κ окислителю не непосредственно, a пo проводнику электрического тока — по внешней цепи. Этот направленный поток электронов представляет собою элек-трический ток. При таком осуществлении окислительно-восстановительной ре-акции ее энергия будет превращена в электрическую энергию, которую можно использовать, включив во внешнюю цепь устройство, потребляющее электриче-скую энергию (например, электронагревательный прибор, электрическую лампу и т. п.).
Устройства, которые применяют для непосредственного преобразования энер-гии химической реакции в электрическую энергию, называются галъванически-ми элементами. Их называют также химическими источниками электрической энергии или химическими источниками тока (сокращенно ХИТ).
B технике гальваническими элементами принято называть только ХИТ, в ко-торых протекают практически необратимые реакции. Такие ХИТ обычно нельзя перезаряжать: они предназначены для однократного использования (в один или несколько приемов). ХИТ, в которых протекают практически обратимые реак-ции, называют аккумуляторами: их можно перезаряжать и использовать мно-гократно.
Действие любого гальванического элемента основано на протекании в нем окислительновосстановительной реакции. B простейшем случае гальванический элемент состоит из двух пластин или стержней, изготовленных из различных ме-таллов и погруженных в раствор электролита. Такая система делает возможным пространствённое разделение окислительно-восстановительной реакции: окисле-ние протекает на одном металле, а восстановление — на другом. Таким образом, электроны передаются от восстановителя κ окислителю по внешней цепи.
Рассмотрим в качестве примера медно-цинковый гальванический элемент, работающий за счет энергии приведенной выше реакции между цинком и сульфа-том меди (рис. 9.3). Этот элемент (элемент Якоби— Даниэля) состоит из медной пластины, погруженной в раствор сульфата меди (медный электрод), и цинко-вой пластины, погруженной в раствор сульфата цин-ка (цинковый электрод). Оба раствора соприкасаются друг с другом, но для предупреждения смешивания они разделены перегородкой, изготовленной из пористого материала.При работе элемента, т. е. при замкнутой цепи, цинк нического элемента. окисляется: на поверхности его соприкосновения с раствором атомы цинка пре-вращаются в ионы и, гидратируясь, переходят в раствор. Высвобождающиеся при этом электроны движутся по внешней цепи κ медному электроду. Вся сово-купность этих процессов схематически изображается уравнением полуреакции, или электрохимическим уравнением:
Zn - 2е -= Zn2+.
Ha медном электроде протекает восстановление ионов меди. Электроны, при-ходящие сюда от цинкового электрода, соединяются с выходящими из раствора дегидратирующимися ионами меди; образуются атомы меди, выделяющиеся в виде металла. Соответствующее электрохимическое уравнение имеет вид:
Cu2+ + 2е- = Cu.
Суммарное уравнение реакции, протекающей в элементе, получится при сло-жении уравнений обеих полуреакций. Таким образом, при работе гальваническо-го элемента электроны от восстановителя переходят κ окислителю по внешней цепи, на электродах идут электрохимические процессы, в растворе наблюдается направленное движение ионов. Направление движения ионов в растворе обусловлено протекающими у элек-тродов электрохимическими процессами. Как уже сказано, у цинкового электро
да катионы выходят в раствор, создавая в нем избыточный положительный заряд, a y медного электрода раствор, наоборот, все время обедня-ется катионами, так что здесь раствор заряжа-ется отрицательно. B результате этого создается электрическое поле, в котором катионы, нахо-дящиеся в растворе (Cu2+ и Zn2+), движутся от цинкового электрода κ медному, а анионы SO4"1" — в обратном направлении. B итоге жидкость у обоих электродов остается электронейтральной. Схема движения электронов и ионов при работе медно-цинкового элемента показана на рис. 9.4. Электрод, на котором протекает окисление, называется анодом. Электрод, на котором про- текает восстановление, называется катодом. B
медно-цинковом элементе цинковый электрод — анод, а медный — катод.
Протекающая в гальваническом элементе окислительно-восстановительная реакция представляет собой сложный процесс. Она включает собственно элек-трохимические стадии (превращения атомов, ионов или молекул на электродах), перенос электронов, перенос ионов. Все эти стадии сопряжены между собой и протекают с одной и той же скоростью; число электронов, которые за единицу времени отдает цинк, равно числу электронов, принимаемых за это же время ио-нами меди. Поэтому скорость реакции, протекающей в гальваническом элементе, пропорциональна количеству электричества, перенесенного по цепи в единицу времени, т. е. силе тока в цепи.
Электрический ток, протекающий по внешней цепи гальванического элемен-та, может производить полезную работу. Ho работа, которую можно выполнить за счет энергии химинеской реакции, зависит от ее скорости: она максимальна при бесконечно медленном — обратимом — проведении реакции. Следовательно, работа, которую можно произвести за счет реакции, протекающей в гальваниче-ском элементе, зависит от величины отбираемого от него тока. Если, увеличивая сопротивление внешней цепи, уменьшать ток до бесконечно малого значения, то и скорость реакции в элементе тоже будет бесконечно малой, а работа — мак-симальной. Теплота, выделяемая во внутренней цепи элемента, будет при этом, наоборот, минимальна.
Работа электрического тока выражается произведением количества прошед-шего по цепи электричества на напряжение. B медно-цинковом элементе при окислении одной молярной массы эквивалентов цинка и одновременном восста-новлении одной молярной массы эквивалентов ионов меди по цепи пройдет коли-чество электричества, численно равное одному фарадею3' (F = 96485 Кл/моль), так что полезная работа W, которую ток может совершить, будет равна
W = FU,
где U — напряжение между полюсами элемента.
Ho поскольку эта работа зависит от силы тока, то и напряжение между по-люсами элемента тоже зависит от силы тока (F — величина постоянная). B предельном случае, отвечающем обратимому протеканию реакции, напряжение будет максимальным. Максимальное значение напряжения гальванического элемента, соответствующее обратимому протеканию реакции, называется напря-жением галъванического элемента (электродвижущей силой) и обозначается ε. Для этого предельного случая полезная работа, производимая электрическим током в медно-цинковом элементе при взаимодействии одной молярной массы эквивалентов цинка с одной молярной массой эквивалентов ионов меди, выра-зится уравнением
2W'макс = FUмакс = Fε,
где ε = Uмакс — напряжение гальванического элемента.
Ясно, что при взаимодействии одного моля атомов цинка с одним молем ионов меди уравнение примет вид:
B общем случае при растворении (или выделении) одного моля вещества, ио ны которого имеют заряд, равный п, максимальная полезная работа связана с напряжением гальванического элемента уравнением:
W = nFε.
При постоянных температуре и давлении максимальная полезная работа ре-акции равна взятому с обратным знаком изменению энергии Гиббса DG. Отсюда:
DG = -nFε.
Если концентрации (точнее говоря, активности) веществ, участвующих в ре-акции, равны единице, т. е. если соблюдаются стандартные условия, то напря-жение гальванического элемента называется его стандартным напряжением и обозначается ε°. При этом последнее уравнение принимает вид:
Учитывая, что стандартное изменение энергии Гиббса реакции связано с ее константой равновесия соотношением
D G° = -RTlnKc,
получим уравнение, связывающее стандартное напряжение гальванического элемента с константой равновесия реакции, протекающей в гальваническом элементе.
Гальванические элементы, типа рассмотренного в разд. 9.6 медно-цинкового элемента с жидким электролитом, неудобны в работе в связи с возможной утеч-кой электролита и громоздкостью. Они обладают большим внутренним сопро-тивлением. Практически гораздо чаще пользуются сухими элементами.
B сухих элементах электролит находится в пастообразном состоянии. Роль анода может играть корпус из активного металла, например, цинка, а катодом является инертный электрод — графитовый стержень (рис. 38.5).
Марганцово-цинковый элементп. Из всех применяемых в настоящее время галь-ванических элементов марганцово-цинковые наиболее распространены. Имеет-ся несколько разновидностей элементов этой системы, но в основе действия их всех лежит окислительно-восстановительная реакция между цинком и диокси-дом марганца. B элементах этой системы один электрод цинковый, другой со-стоит из МnО2. Оба электрода находятся в растворе хлорида аммония. При работе элемента цинк окисляется:
2Zn -4е -= 2Zn2+.
Часть образующихся ионов цинка связывается молекулами аммиака в ком-плексный ион:
Zn2++ 4NH3 = [Zn(NHa)4]2+.
Молекулы аммиака образуются в растворе вследствие гидролиза иона аммо-ния:
4NH+ + 4H2O <=> 4NH3 + 4H3O+.
Электроны, получающиеся при окислении цинка, по внешней цепи перехо-дят κ диоксиду марганца, который ири этом восстанавливается. B результате восстановления MnO2 получается смесь нескольких продуктов. B наибольшем количестве получается соединение MnO(OH), в котором степень окисления мар-ганца равна +3:
4MnO2 + 4H3O+ + 4е - = 4MnO(OH) + 4H2O.
 Таким образом, цинковый электрод элемента является анодом и заряжен от-рицательно, а электрод из MnO2 служиткатодом и заряжен положительно.
Таким образом, цинковый электрод элемента является анодом и заряжен от-рицательно, а электрод из MnO2 служиткатодом и заряжен положительно.
Имеющиеся в растворе ионы NH+ и С1- при работе элемента движутся в направлениях, обусловленных процессами, протекающими на электродах. По-скольку у цинкового электрода катионы цинка выходят в раствор, a у катода раствор все время обедняется катионами H+, то в создающемся электрическом поле ионы NH+ движутся при работе элемента κ катоду, а ионы Cl- — κ аноду. Таким образом, раствор во всех его частях остается электронейтральным.
Если сложить последние четыре уравнения, отвечающие отдельным проте-кающим при работе элемента процессам, то получится суммарное уравнение окислительно-восстановительной реакции, идущей в элементе:
2Zn + 4MnO2 + 4NH+ = Zn2+ + [Zn(NH3)4]2+ + 4MnO(OH).
Марганцово-цинковые элементы не содержат в себе раствора в обычном по-нимании этого слова. Необходимый для их работы раствор NH4Cl в одних кон-струкциях имеет консистенцию пасты (рис. 38.5), в других им пропитан пори-стый картон, помещаемый между электродами.
Марганцово-цинковые элементы (элементы Лекланше) широко применяются в качестве источников электропитания установок связи, различных измеритель-ных приборов, карманных фонарей, полевых установок связи.
B сухом элементе вместо хлорида аммония можно использовать щелочь KOH, такие элементы называют щелочными.
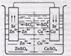 Воздушно-цинковый элемент. Здесь отрицательным электродом является цинк, а активным веществом положительного электрода служит кислород воз-духа (поры электрода, изготовляемого из смеси активного угля с графитом, за-полнены воздухом). Кислород диффундирует κ поверхности раздела электрод — раствор. B качестве электролита применяются растворы NaOH или NH4Cl. При работе такого элемента в нем протекает окислительновосстановительная реакция, которая в случае щелочного электролита выражается уравнением
Воздушно-цинковый элемент. Здесь отрицательным электродом является цинк, а активным веществом положительного электрода служит кислород воз-духа (поры электрода, изготовляемого из смеси активного угля с графитом, за-полнены воздухом). Кислород диффундирует κ поверхности раздела электрод — раствор. B качестве электролита применяются растворы NaOH или NH4Cl. При работе такого элемента в нем протекает окислительновосстановительная реакция, которая в случае щелочного электролита выражается уравнением
Zn + 1/2Ο2 + 2NaOH = Na2ZnO2 + H2O.
Топливные элементы. Для непосредственного преобразования тепловой энер-гии сгорания топлива в электрическую служат топливные элементы. Топливный элемент работает благодаря непрерывно поступающим в него и разделенным в пространстве электролитом окислителю и восстановителю. Проходя через по-ристые электроды, изготовленные из спрессованного графита, и контактируя с электролитом, восстановитель окисляется, а окислитель восстанавливается. Разность электродных потенциалов определяет напряжение элемента. Электро литом может служить раствор кислоты или щелочи, расплав соли. B качестве окислителей берут кислород или воздух, а как восстановители берутся водород, горючие газы или жидкости. Электродные процессы при работе топливного эле-мента состоят из двух полуреакций окислительновосстановительной реакции. Например, в водородно-кислородном топливном элементе с раствором щелочи в качестве электролита протекают следующие процессы:
2Н2(Г) + 4OH-(p) - 4е- = 4Н2О(ж),
О2(Г) + 2Н2О(ж) + 4е- = 4OH-(p) Суммарная реакция сводится κ процессу:
2Н2(г) + 02 (г)= 2Н2О(ж).
Аккумуляторы
Химические источники тока, предназначенные для многократного их исполь-зования за счет регенерации активных компонентов электродов в процессе за-рядки, называются аккумуляторами.
Широко распространены свинцовые и никелевые аккумуляторы.
Свинцовый аккумулятор. Готовый κ употреблению свинцовый аккумуля-тор состоит из решетчатых свинцовых пластин, одни из которых заполнены диоксидом свинца, а другие — металлическим губчатым свинцом. Пластины погружены в 35—40%-ный раствор H2SO4; при этой концентрации удельная электрическая проводимость раствора серной кислоты максимальна.
При работе аккумулятора — при его разряде — в нем протекает окислительно-восстановительная реакция, в ходе которой металлический свинец окисляется
Pb + S042--2e- = PbSO4, а диоксид свинца восстанавливается:
PbO2 + SO42- + 4H+ + 2е- = PbSO4 + 2H2O.
Электроны, отдаваемые атомами металлического свинца при окислении, при-нимаются атомами свинца PbO2 при восстановлении; электроны передаются от одного электрода κ другому по внешней цепи.
Таким образом, металлический свинец служит в свинцовом аккумуляторе ано-дом и заряжен отрицательно, a PbO2 служит катодом и заряжен положительно.
Bo внутренней цепи (в растворе H2SO4) при работе аккумулятора происходит перенос ионов. Ионы SO4 движутся κ аноду, а ионы H+ — κ катоду. Напра-вление этого движения обусловлено электрическим полем, возникающим в ре-зультате протекания электродных процессов: у анода расходуются анионы, a y катода — катионы. B итоге раствор остается электронейтральным. Если сложить уравнения, отвечающие окислению свинца и восстановлению PbO2, то получится суммарное уравнение реакции, протекающей в свинцовом аккумуляторе при его работе (разряде):
Pb + PbO2 + 4H+ + S042- = 2PbSO4 + 2H2O.
 Напряжение заряженного свинцового аккумулятора равно приблизительно 2 B. По мере разряда аккумулятора материалы его катода (PbO2) и анода (Pb) расходуются. Расходуется и серная кислота. При этом напряжение на зажи-мах аккумулятора падает. Когда оно становится меньше значения, допускаемого условиями эксплуатации, аккумулятор вновь заряжают.
Напряжение заряженного свинцового аккумулятора равно приблизительно 2 B. По мере разряда аккумулятора материалы его катода (PbO2) и анода (Pb) расходуются. Расходуется и серная кислота. При этом напряжение на зажи-мах аккумулятора падает. Когда оно становится меньше значения, допускаемого условиями эксплуатации, аккумулятор вновь заряжают.
Для зарядки (или заряда) аккумулятор подключают κ внешнему источнику тока (плюсом k плюсу и минусом κ минусу). При этом ток протекает через ак-кумулятор в направлении, обратном тому, в котором он проходил при разряде аккумулятора. B результате этого электрохимические процессы на электродах «обращаются». Ha свинцовом электроде теперь происходит процесс восстано-вления
PbSO4 + 2е- = Pb + S042-, т. е. этот электрод становится катодом.
Электролит свинцового аккумулятора представляет собой раствор серной ки-слоты, содержащий сравнительно малое количество ионов Pb2+. Концентрация ионов водорода в этом растворе намного болыпе, чем концентрация ионов свин-ца. Кроме того, свинец в ряду напряжений стоит до водорода. Тем не менее при зарядке аккумулятора на катоде восстанавливается именно свинец, а не водо-род. Это происходит потому, что перенапряжение выделения водорода на свинце особенно велико (см. разд. 9.10, табл. 9.3). Ha электроде из PbO2 при зарядке идет процесс окисления
PbSO4 + 2H2O - 2е2- = PbO2 + 4H+ + S042-,
следовательно, этот электрод является теперь анодом. Ионы в растворе дви-жутся в направлениях, обратных тем, в которых они перемещались при работе аккумулятора.
Суммируя два последние уравнения, получим уравнение реакции, протекаю-щей при зарядке аккумулятора:
2PbSO4 + 2H2O = Pb + PbO2 + 4H+ + 2S042-.
Нетрудно заметить, что этот процесс противоположен тому, который протека-ет при работе аккумулятора: при зарядке аккумулятора в нем вновь получаются вещества, необходимые для его работы.
Щелочные кадмиево-никелевые и железо-никелевые аккумуляторы. Кадмиево-никелевые (условное обозначение KH) и железо-никелевые (ЖН) ак-кумуляторы весьма сходны между собой. Основное их различие состоит в мате-риале пластин отрицательного электрода: в аккумуляторах KH они кадмиевые. а в аккумуляторах ЖН — железные. Наиболее широкое применение имеют ак-кумуляторы KH.
Щелочные аккумуляторы в основном выпускаются с ламельными злектро-дами. B них активные массы заключены в ламели — плоские коробочки с от-верстиями. Активная масса положительных пластин заряженного аккумулято-ра в основном состоит из гидратированного оксида никеля(Ш) Ni2Os-H2O или NiO(OH). Кроме того, в ней содержится графит, добавляемый для увеличения электрической проводимости. Активная масса отрицательных пластин аккуму-ляторов KH состоит из смеси губчатого кадмия с порошком железа, а аккуму-ляторов ЖН — из порошка восстановленного железа. Электролитом служит раствор гидроксида калия, содержащий небольшое количество LiOH. Рассмотрим процессы, протекающие при работе аккумулятора KH. При раз-ряде аккумулятора кадмий окисляется.
Cd + 2OH- - 2е- = Cd(OH)2, a NiO(OH) восстанавливается:
2NiO(OH) + 2H2O + 2е- = 2Ni(OH)2 + 20Н-.
По внешней цепи при этом происходит перенос электронов от кадмиевого элек-трода κ никелевому. Кадмиевый электрод служит анодом и заряжен отрицатель-но, а никелевый — катодом и заряжен положительно.
Суммарную реакцию, протекающую в аккумуляторе KH при его работе, мож-но выразить уравнением, которое получится при сложении двух последних элек-трохимических уравнений:
2NiO(OH) + 2H2O + Cd = 2Ni(OH)2 + Cd(OH)2.
Напряжение заряженного кадмиево-никелевого аккумулятора равно прибли-зительно 1,4 B. По мере работы (разряда) аккумулятора напряжение на его зажимах падает. Когда оно становится ниже 1 B, аккумулятор заряжают.
При зарядке аккумулятора электрохимические процессы на его электродах «обращаются». Ha кадмиевом электроде происходит восстановление металла
Cd(OH)2 + 2е- = Cd + 20Н-, на никелевом-окисление гидроксида никеля (II):
2Ni(OH)2 + 20Н- - 2е - = 2NiO(OH) + 2H2O.
Суммарная реакция при зарядке обратна реакции, протекающей при разряде: 2Ni(OH)2 + Cd(OH)2 = 2NiO(OH) + 2H2O + Cd.
Серебряно-цинковые акумуляторы. B серебряно-цинковых аккумулято-рах, обладающих хорошими электрическими характеристиками и имеющих ма-лую массу и объем, электродами служат оксиды серебра Ag2O, AgO (катод) и губчатый цинк (анод); электролитом служит раствор KOH.
При работе аккумулятора цинк окисляется, превращаясь в ZnO и Zn(OH)2, a оксид серебра восстанавливается до металла. Суммарную реакцию, протекаю-щую при разряде аккумулятора, можно приближенно выразить уравнением:
AgO + Zn = Ag + ZnO.
Напряжение заряженного серебряно-цинкового аккумулятора приближенно равно 1,85 B. При снижении напряжения до 1,25 B аккумулятор заряжают. При этом процессы на электродах «обращаются»: цинк восстанавливается, серебро окисляется — вновь получаются вещества, необходимые для работы аккумуля-тора.
В 28
Электролиз
Электролизом называется процесс разложения вещества электрическим током.
Сущность электролиза заключается в том, что при пропускании тока через раствор электролита (или расплавленный электролит) положительно заряженные ионы перемещаются к катоду, а отрицательно заряженные – к аноду. Достигнув электродов, ионы разряжаются, в результате чего у электродов выделяются составные части растворенного электролита или водород и кислород из воды.
Для перевода различных ионов в нейтральные атомы или группы атомов требуется различное напряжение электрического тока. Одни ионы легче теряют свои заряды, другие труднее. Степень легкости, с которой разряжаются (присоединяют электроны) ионы металлов, определяется положением металлов в ряду напряжений. Чем левее стоит металл в ряду напряжений, чем больше его отрицательный потенциал (или меньше положительный потенциал), тем труднее при прочих равных условиях разряжаются его ионы (легче всего разряжаются ионы Аu3+, Ag+; труднее всего Li+, Rb+, K+).
Если в растворе одновременно находятся ионы нескольких металлов, то в первую очередь разряжаются ионы того металла, у которого отрицательный потенциал меньше (или положительный – больше). Например, из раствора, содержащего ионы Zn2+ и Cu2+, сперва выделяется металлическая медь. Но величина потенциала металла зависит также и от концентрации его ионов в растворе; точно также изменяется и легкость разряда ионов каждого металла в зависимости от их концентрации: увеличение концентрации облегчает разряд ионов, уменьшение – затрудняет. Поэтому при электролизе раствора, содержащего ионы нескольких металлов может случиться, что выделение более активного металла будет происходить раньше, чем выделение менее активного (если концентрация ионов первого металла значительна, а второго – очень мала).
В водных растворах солей, кроме ионов соли, всегда имеются еще и ионы воды (Н+ и ОН-). Из них ионы водорода будут разряжаться легче, чем ионы всех металлов, предшествующих водороду в ряду напряжений. Однако ввиду ничтожной концентрации водородных ионов при электролизе всех солей, кроме солей наиболее активных металлов, у катода происходит выделение металла, а не водорода. Только при электролизе солей натрия, кальция и других металлов до алюминия включительно разряжаются ионы водорода и выделяется водород.
У анода могут разряжаться или ионы кислотных остатков или гидроксильные ионы воды. Если ионы кислотных остатков не содержат кислорода (Cl-, S2-, CN- и др.), то обычно разряжаются именно эти ионы, а не гидроксильные, которые теряют свой заряд значительно труднее, и у анода выделяются Cl2, S и т.д. Наоборот, если электролизу подвергается соль кислородсодержащей кислоты или сама кислота, то разряжаются гидроксильные ионы, а не ионы кислородных остатков. Образующиеся при разряде гидроксильных ионов нейтральные группы ОН тотчас же разлагаются по уравнению: 4OH ® 2H2O + O2
В результате у анода выделяется кислород.
Электролиз раствора хлорида никеля NiCl2
Раствор содержит ионы Ni2+ и Cl-, а также в ничтожной концентрации ионы Н+ и ОН-. При пропускании тока ионы Ni2+ перемещаются к катоду, а ионы Cl- – к аноду. Принимая от катода по два электрона, ионы Ni2+ превращаются в нейтральные атомы, выделяющиеся из раствора. Катод постепенно покрывается никелем.
Ионы хлора,достигая анода, отдают ему электроны и превращаются в атомы хлора, которые, соединяясь попарно, образуют молекулы хлора. У анода выделяется хлор.
Таким образом, у катода происходит процесс восстановления, у анода – процесс окисления.
 2018-01-21
2018-01-21 888
888








