 №25
№25
Свойства дисперсных систем:
Коллигативные:
Диффузия – самопроизвольный процесс выравнивания концентрации молекул, ионов под влиянием их теплового движения.
Броуновское движение – непрерывное беспорядочное движение частиц, не затухающее во времени. (беспорядочное движение малых частиц, взвешенных в жидкости или газе, происходящее под действием толчков со стороны молекул окружающей среды.)
Осмос – процесс самопроизвольного одностороннего перехода молекул растворителя через полупроницаемую мембрану из растворителя в раствор или из раствора с меньшей концентрацией вещества в раствор с большей концентрацией.
Седиментация – процесс оседания частиц дисперсной фазы в жидкой или газообразной среде под действием силы тяжести.
Получение дисперсных систем:
1. Пептизацией называют переход осадков в коллоидный раствор под действием специальных стабилизирующих добавок (пептизаторов), либо за счет удаления из системы ионов, способствующих агрегации частиц. В роли пептизаторов могут выступать раствор электролита, поверхностно-активного вещества или растворитель.
2. К конденсационным способам получения дисперсных систем относятся конденсация, кристаллизация и десублимация. Они основаны на образовании новой фазы в условиях пересыщенного состояния веществ в газовой или жидкой среде. Необходимым условием конденсации являетсяпересыщение и неравномерное распределение веществ в дисперсионной среде (флуктуации концентрации), а также образование центров конденсации или зародышей. При этом система из гомогенной переходит в гетерогенную. Конденсация и десублимация характерны для газовой, а кристаллизация для жидкой среды.
Суспензии — это дисперсные системы, в которых дисперсной фазой являются частицы твердого вещества размером более 10-7 м, а дисперсионной средой — жидкость.
МЕТОДЫ ПОЛУЧЕНИЯ РАЗБАВЛЕННЫХ СУСПЕНЗИЙ
Суспензии, так же как и любую другую дисперсную систему, можно получить двумя группами методов:
со стороны грубодисперсных систем — диспергационными методами,
со стороны истинных растворов — конденсационными методами.
Рассматривая конкретные методы получения суспензий, полезно вспомнить, что суспензии — это взвеси порошков в жидкости. Следовательно, наиболее простым и широко распространенным как в промышленности, так и в быту методом получения разбавленных суспензий является взбалтывание соответствующего порошка в подходящей жидкости с использованием различных перемешивающих устройств (мешалок, миксеров и т. д.). Для получения концентрированных суспензий (паст) соответствующие порошки растирают с небольшим количеством жидкости,
Так как суспензии отличаются от лиозолей только тем, что частицы в них на несколько порядков больше, все методы, которые используются для получения лиозолей, можно применять и для получения суспензий. При этом необходимо, чтобы степень измельчения диспергационными методами была меньше, чем при получении лиозолей. При конденсационных методах конденсацию необходимо проводить так, чтобы образовывались частицы, имеющие размеры 10-7-10-4 м. Размер образующихся частиц зависит от соотношения скоростей образования зародышей кристаллов и их роста. При небольших степенях пересыщения обычно образуются крупные частицы, при больших — мелкие. Предварительное введение в систему зародышей кристаллизации приводит к образованию практически монодисперсных суспензий. Уменьшение дисперсности может быть достигнуто в результате изотермической перегонки при нагревании, когда мелкие кристаллы растворяются, а за их счет растут крупные.
Суспензии образуются также в результате коагуляции лиозолей. Следовательно, способы осуществления коагуляции (объединение мелких диспергированных частиц в бо́льшие по размеру агрегаты)— это одновременно и методы получения суспензий.
Эмульсия – дисперсная система, состоящая из микроскопических капель жидкости (дисперсной фазы), распределенных в другой жидкости (дисперсионной среде).
Эмульсии могут образовываться самопроизвольно, искусственно их можно получить в результате механического диспергирования жидкостей, гомогенизации и другими способами.
Самопроизвольное эмульгирование характерно только для лиофильных систем и определяется минимальным значением межфазового поверхностного натяжения
Для получения и стабилизации эмульсий используют гомогенизацию. Этот способ, характерный только для эмульсий, заключается в продавливании жидкости через отверстия. Образующиеся тонкие струйки жидкости неустойчивы и распадаются на капли; из них формируется дисперсная фаза. Гомогенизация позволяет получать эмульсии и уменьшать размеры капель, что повышает устойчивость эмульсии. Для этой цели капли грубодисперсной эмульсии продавливают через отверстие небольших размеров. Гомогенизация позволяет получить монодисперсную или близкую к ней систему.
Получение эмульсии
1. путём дробления капель.
Этот метод осуществляется путём медленного прибавления диспергируемого вещества в дисперсную систему в присутствии эмульгатора при непрерывном и сильном перемешивании. Главными факторами, от которых зависит степень дисперсности частиц получаемой эмульсии и её устойчивость, является скорость перемешивания, скорость введения диспергируемого вещества, его количество, природа эмульгатора и его концентрация, температура и pH среды.
2.путём образования плёнок и их разрыва на мелкие капли.
Механизм образования состоит в следующем. Жидкость, образующая дисперсную фазу (например, масло), при медленном прибавлении к дисперсионной среде образует плёнку. Эта плёнка разрывается пузырьками воздуха, выходящими из отверстия трубки, которые находятся на дне сосуда. Образуются мелкие единичные капли. Одновременно пузырьки воздуха энергично размешивают всю жидкость и этим самым способствуют дальнейшему эмульгированию. В настоящее время для получения концентрированной эмульсии масла с водой её подвергают действию ультразвука.
Коллоидный раствор -высокодисперсные двухфазные системы, состоящие из дисперсионной среды и дисперсной фазы, причем линейные размеры частиц последней лежат в пределах от 1 до 100 нм.
Методы получения коллоидных растворов: диспергирование( тонкое измельчение твёрдых тел или жидкостей, в результате чего получают порошки, суспензии, эмульсии) и конденсация ( способы получения коллоидных растворов путем объединения молекул и ионов в агрегаты коллоидных размеров)
Диспергационные:
1. Измельчение крупных образцов вещества до частиц дисперсных размеров
2. Химический состав и агрегатное состояние вещества не меняется
3. Затрачивается внешняя работа
4. Используется в промышленности для получения грубодисперсных систем
Конденсационные:
1. Основаны на ассоциации молекул в агрегаты из истинных растворов
2. Меняется химический состав вещества
3. Используют для получения высокодисперсных систем
4. Не требуют затраты внешней работы
5. Появление новой азы происходит при пересыщении среды
Диализ — очистка коллоидных растворов и субстанций высокомолекулярных веществ от растворённых в них низкомолекулярных соединений при помощи полупроницаемой мембраны.
Электродиализ — процесс изменения концентрации электролита в растворе под действием электрического тока. Электродиализ применяют для опреснения воды, выделения солей из растворов.
Ультрафильтрация — метод коррекции водного гомеостаза при избытке воды в организме путем удаления из крови безбелковой жидкости через естественные или искусственные мембраны, играющие роль ультрафильтра
.
Искусственная почка — аппарат для временного замещения выделительной функции почек. Основной задачей аппарата искусственной почки является очищение крови от различных токсичных веществ, в том числе продуктов метаболизма. При этом объём крови в пределе организма остаётся постоянным.
В основе работы аппарата лежит принцип диализа — удаление низкомолекулярных веществ из коллоидных растворов за счет диффузии и разницы осмотического давления с обеих сторон полупроницаемой целлофановой мембраны. Ионы калия, натрия, кальция, хлора, молекулы мочевины, креатинина, аммиака и др. свободно проникают через поры целлофана. В то же время более крупные молекулы белка, форменные элементы крови и бактерии не могут преодолеть целлофанового барьера.
Кровь от больного поступает по катетеру при помощи насоса в диализатор, который крепится на баке, вмещающем 110 л диализирующего раствора. Проходя между целлофановыми пластинами диализатора, кровь больного через целлофановую мембрану соприкасается с протекающим навстречу диализирующим раствором. После диализатора кровь попадает в измеритель производительности и далее через фильтр и воздухоулавливатель по катетеру возвращается в венозную систему больного. Протекающая диализирующая жидкость стандартна и содержит все основные ионы крови (К·, Na· и др.), глюкозу в концентрации, соответствующей концентрации таковых в крови здорового человека.
Свойства коллоидных систем:
Диффузия – самопроизвольный процесс выравнивания концентрации молекул, ионов под влиянием их теплового движения.
Броуновское движение – непрерывное беспорядочное движение частиц, не затухающее во времени. (беспорядочное движение малых частиц, взвешенных в жидкости или газе, происходящее под действием толчков со стороны молекул окружающей среды.)
Осмос – процесс самопроизвольного одностороннего перехода молекул растворителя через полупроницаемую мембрану из растворителя в раствор или из раствора с меньшей концентрацией вещества в раствор с большей концентрацией.
Осмотическое давление – минимальное гидростатическое давление, которое нужно приложить к раствору, чтобы осмос прекратился.
Седиментация – процесс оседания частиц дисперсной фазы в жидкой или газообразной среде под действием силы тяжести.
Закон Рэлея отражает зависимость интенсивности рассеянного света I р от следующих факторов:
Теория рассеивания света разработана Рэлеем в 1871 году, который вывел для сферических частиц уравнение, связывающее интенсивность падающего света (I0) с интенсивностью света, рассеянного единицей объема системы (Ip).

где I, I0 - интенсивность рассеянного и падающего света, Вт/м2; кр - константа Рэлея, постоянная, зависящая от показателей преломления веществ дисперсной фазы и дисперсионной среды, м-3; сv - концентрация частиц золя, моль/л; λ - длина волны падающего света, м; r - радиус частицы, м.
Электрофорез - перемещение частиц дисперсной фазы относительно неподвижной дисперсионной среды под действием внешнего электрического поля. Положительно заряженные гранулы под действием электрического поля перемещяются к котоду, а отрицательные противоионы диффузионного слоя – к аноду.
Электроосмос - перемещение дисперсионной среды относительно неподвижной десперсионной фазы под действием внешнего электрического поля. Под действием внешнего Эл. Поля положительно заряженные противоионы диффузионного слоя вмечте с гидратной оболочкой перемещяются к катоду.
Потенциал течения (протекания) – это явление возникновения разности потенциалов при перемещении дисперсионной среды через капиллярно-пористую перегородку.
Потенциал седиментации — это явление возникновения потенциалов на электродах, расположенных на разной высоте в сосуде, в котором происходит оседание частиц дисперсной фазы.
Двойной электрический слой (межфазный) (ДЭС) — слой ионов, образующийся на поверхности частиц в результате адсорбции ионов из раствора, диссоциации поверхностного соединения или ориентирования полярных молекул на границе фаз.
Согласно современной теории структуру ДЭС составляют два слоя:
· Слой Гельмгольца или адсорбционный слой, примыкающий непосредственно к межфазной поверхности. Этот слой имеет толщину δ, равную радиусу потенциалопределяющих ионов в несольватированном состоянии.
· Диффузный слой или слой Гуи, в котором находятся противоионы. Диффузный слой имеет толщину λ, которая зависит от свойств системы и может достигать больших значений. Толщина диффузного слоя рассчитывается по формуле:
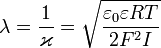
При движении жидкости относительно твердой поверхности на границе адсорбционной и диффузионной частей двойного слоя возникает разность потенциалов, называемая электрокинетическим потенциалом или дзета-потенциалом (ζ-потенциал).
Электрокинетический потенциал зависит от толщины диффузной части двойного слоя. Чем толще диффузный слой, тем больше электрокинетический потенциал, тем больше силы электростатического отталкивания, действующие между коллоидными частицами, тем выше устойчивость коллоидных систем. При переходе ионов диффузионного слоя в адсорбционный, толщина диффузионного слоя уменьшается, электрокинетический потенциал снижается, и раствор теряет устойчивость.
Электрокинетический потенциал или дзета-потенциал. Этот потенциал соответствует плоскости скольжения и является частью потенциала диффузного слоя.
Электрокинетический потенциал зависит от природы поверхности контактирующих фаз. Различают активные и инактивные поверхности. В водной среде активные поверхности образуют полиэлектролиты и другие ионогенные вещества, многие неорганические оксиды (например, SiO2, Al2O3, FeO). Инактивные поверхности в водной характерны для веществ, не образующих ионогенных групп (графит, масли и др.). Заряд на них может возникать в результате адсорбции ионов ПАВ дифильного строения.
№26
Устойчивость дисперсных систем – это возможность их нахождения в исходном состоянии неопределенно долгое время. (способность дисперсных систем сохранять свой состав неизменным, когда концентрация дисперсной фазы и распределение частиц по размерам остаются постоянными во времени.)
Устойчивость дисперсных систем может быть:
1. К осаждению дисперсной фазы - характеризует способность дисперсной системы сохранять равновесноераспределение фазы по объему дисперсионной среды или ее устойчивость к разделению фаз. Это свойство называется седиментационная (кинетическая) устойчивость.
2. К агрегации ее частиц. Агрегативная устойчивость – это способность дисперсной системы сохранять неизменной во времени степень дисперсности, т.е. размеры частиц и их индивидуальность.
Она обусловлена способностью дисперсных систем образовывать агрегаты (т.е. укрупняться).
Дисперсные системы также делят на:
• лиофильные, обладающие термодинамической устойчивостью;
• лиофобные, которые термодинамически неустойчивы к агрегации, но могут быть устойчивы кинетически, т.е. обладать значительным временем жизни.
Седиментационная устойчивость – это способность системы противодействовать оседанию частиц (силе тяжести). способность дисперсной системы сохранять равновесное распределение фазы по объему дисперсионной среды или ее устойчивость к разделению фаз.
Агрегативная устойчивость – это способность дисперсной системы сохранять неизменной во времени степень дисперсности, т.е. размеры частиц и их индивидуальность. (способность частиц дисперсной фазы противостоять агрегации, слипанию)
Конденсационная устойчивость характеризует способность дисперсных систем сохранять неизменной с течением времени удельную поверхность.
Коагуляцией называется потеря коллоидными системами агрегативной устойчивости.
Коагуляция коллоидных растворов может быть вызвана воздействием различных факторов: концентрированием дисперсной фазы, диализом, механическим воздействием, изменением температуры, различными видами излучений, добавлением электролитов.
При коагуляции коллоидных растворов происходит изменение размеров и числа кинетически активных частиц. Процесс коагуляции можно разделить на две стадии: скрытую и явную.
Минимальная концентрация электролита, по достижении которой начинается коагуляция, называется порогом коагуляции
Факторы устойчивости коллоидных растворов:
1. наличие электрического заряда коллоидных частиц. Частицы несут одноименный заряд, поэтому при встрече частицы отталкиваются;
2. способность к сольватации (гидратации) ионов диффузного слоя. Чем более гидратированы ионы в диффузном слое, тем толще общая гидратная оболочка, тем стабильнее система. Упругие силы сольватных слоев оказывают расклинивающее действие на дисперсные частицы и не дают им сближаться;
3. адсорбционно-структурирующие свойства систем. Третий фактор связан с адсорбционными свойствами дисперсных систем. На развитой поверхности дисперсной фазы легко абсорбируются молекулы поверхностно-активных веществ (ПАВ) и высокомолекулярных соединений (ВМС). Большие размеры молекул, несущих собственные сольватные слои, создают на поверхности частиц адсорбционно-сольватные слои значительной протяженности и плотности. Такие системы по устойчивости близки к лиофильным системам. Все эти слои обладают определенной структурой, создают по П.А. Ребиндеру структурно-механический барьер на пути сближения дисперсных частичек.
№27
Окислительно-восстановительные реакции – химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем (акцептором) и атомом-восстановителем (донором).
 2018-01-21
2018-01-21 6253
6253








