Виды энергетических эффектов
Практически любая реакция сопровождается энергетическим эффектом:
• Выделением или поглощением тепла
• Света
• Электричества
• Совершением работы
Предмет химической термодинамики
Изучает законы, которые управляют энергетическими эффектами химических и биохимических реакций
• Переход энергии из одной формы в другую, от одной части системы к другой
• Возможность и направление протекания самопроизвольных процессов
Особенности химической термодинамики
• Имеет дело только с макроскопическими объектами
• Не использует в своих законах понятие времени
• Не изучает скорость процессов, изучает различные состояния системы
Термодинамическая система
• Произвольно выбранная часть пространства, заполненная одним или совокупностью нескольких веществ и отделенная от окружающей среды реальной или гипотетической (мысленной) поверхностью раздела
Например, раствор веществ в колбе – система, а воздух, отделенный поверхностью раздела и стеклом – внешняя среда
Термодинамические параметры системы
• Объем системы
• Масса системы
• Масса или концентрация компонентов
• Температура
• Давление
Функции состояния системы
• Энергетические характеристики, которые зависят от термодинамических параметров, характеризующих состояние, и не зависят от способа достижения данного состояния системы (внутренняя энергия Е, энтальпия Н)
Классификация систем
• Изолированная – система не обменивается с внешней средой ни энергией, ни веществом
• Закрытая – система обменивается с внешней средой энергией, но не обменивается массой
• Открытая – система обменивается с внешней средой и энергией и массой
• Гомогенная – система, которая включает в себя один или несколько компонентов в одном агрегатном состоянии, не имеющих поверхности раздела
• Гетерогенная – система, которая включает в себя несколько компонентов в различном агрегатном состоянии, имеющих поверхность раздела
Физически гомогенная часть системы, которую можно отделить механическим путем – фаза
Первый закон термодинамики
Это частное выражение более общего закона природы о сохранении материи и ее движения
• Разные формы энергии не исчезают и не возникают из ничего, а переходят друг в друга в строго эквивалентном соотношении
Математическое выражение
• Для изолированной системы общий запас внутренней энергии остается постоянным
DЕ = 0
• Для закрытой системы энергия, полученная системой в форме теплоты расходуется на увеличение внутренней энергии и на совершение работы
Q = DЕ + А
Полная энергия системы
• Кинетическая – энергия движения системы как целого
• Потенциальная – энергия, обусловленная положением системы в каком-либо внешнем поле
• Внутренняя - энергия, которой обладают атомы и молекулы и освобождающаяся при химических или физических процессах
Внутренняя энергия (Е)
• Кинетическая энергия поступательного, вращательного и колебательного движения частиц в системе
• Потенциальная энергия взаимодействия между частицами (притяжения и отталкивания)
• Потенциальная энергия, обусловленная силами межмолекулярной (межатомной) химической связи и конфигурации молекул
E =? DЕ = Е2 – Е1
Измеряют в ккал/моль или в кДж/моль
Формы обмена энергией
• Работа – упорядоченная форма передачи энергии, сопровождающаяся переносом частиц вещества в определенном направлении (работа расширения)
• Теплообмен – неупорядоченная форма передачи энергии; происходит в результате хаотического теплового движения молекул и не сопровождается переносом вещества
Работа
• В химических процессах наиболее часто встречается механическая работа, связанная с преодолением внешнего давления, действующего на систему, в которой протекает химическая реакция с изменением объема реагирующих веществ
Пример
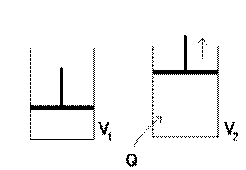
А = рDV
DV = V2 – V1
Тепловой эффект химической реакции
• Относят к 1 молю вещества и к определенному агрегатному состоянию
Реакция эндотермическая: +Q
Реакция экзотермическая: -Q
2H2(г) + O2(г) = 2H2O(ж); Q = -285 кДж/моль
2H2(г) + O2(г) = 2H2O(г); Q = -242 кДж/моль
2H2(г) + O2(г) = 2H2O(ж) + 570 кДж
Примеры тепловых эффектов
Значение тепловых эффектов химических реакций колеблется от 4 до 4000 кДж/моль
| Процесс | Тепловой эффект |
| Жидкость – пар | 40 – 250 кДж/моль |
| Твердое тело – жидкость | 4 – 20 кДж/моль |
| Аморфное состояние – кристалл | 4 – 20 кДж/моль |
| Растворение | 20 – 40 кДж/моль |
| Нейтрализация | 57,3 кДж/моль |
Энтальпия (теплосодержание) Н
Химические реакции могут протекать:
• При постоянном давлении – изобарные процессы
• При постоянном объеме – изохорные
• При постоянной температуре – изотермические
• Система не обменивается теплотой с окружающей средой – адиабатические
Большинство реакций – изобарные. Для них:
Q = DE + A; A = pDV
Q = DE + pDV
DE = E2 – E1; DV = V2 – V1
Q = E2 – E1 + pV2 – pV1 = (E2 + pV2) – (E1 + pV1)
E1 + pV1 = H1; Е2 + рV2 = Н2
Q = H2 – H1 = DH
Величина теплового эффекта для изобарного процесса равна изменению энтальпии, если единственным видом работы является работа расширения
Определение
• Энтальпия – функция состояния, приращение которой равно теплоте, полученной системой в изобарном процессе
Для термохимических расчетов необходимо, чтобы энтальпии реакции были отнесены к стандартным условиям, иначе значения DН будут несопоставимы:
Р = 1атм; Т = 298°К (25°С)
Стандартная энтальпия образования вещества (DН°298)
• Для сложного вещества: изменение энтальпии системы DН, сопровождающееся образованием 1 моля вещества из простых веществ при стандартных условиях
• Для простого вещества: DН°298 в стандартном состоянии условно считают равной 0 (О2)
Для многих реакций изменение энтальпии можно рассчитать с помощью справочных таблиц стандартных энтальпий образования продуктов и исходных веществ
Стандартные теплоты образования некоторых соединений
| Вещество | Теплота образования |
| Мочевина (т) | 333 кДж/моль |
| Глицерин (ж) | 668 кДж/моль |
| Уксусная кислота (ж) | 488 кДж/моль |
| CO2 (г) | 393 кДж/моль |
| H2O (ж) | 285 кДж/моль |
| H2O (г) | 242 кДж/моль |
| NaCl (т) | 411 кДж/моль |
| HCl (г) | 167 кДж/моль |
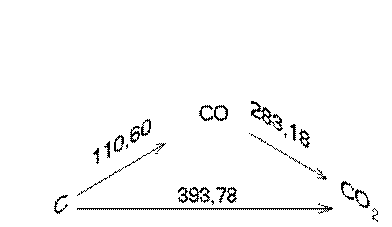
Закон Гесса
Суммарный тепловой эффект реакции не зависит от промежуточных состояний и путей перехода, а зависит только от начального и конечного состояния системы
Следствия из закона Гесса
№1. Тепловой эффект реакции равен разности сумм теплот образования продуктов реакции и сумм теплот образования исходных веществ с учетом количества всех молей, участвующих в реакции
DН°298 = ∑ Н°298 - ∑ Н°298
реакции тепл. обр. продуктов тепл. обр. исходных вв
№2. Тепловой эффект реакции равен разности сумм теплот сгорания исходных веществ и сумм теплот сгорания продуктов реакции
DН°298 = ∑ Н°298 - ∑ Н°298
реакции тепл. сгор. исходных вв тепл. сгор. продуктов
№3. Тепловой эффект образования вещества равен тепловому эффекту разложения с обратным знаком (частный закон Лавуазье-Лапласа)
DН°298 = - DН°298
образования разложения
№4. Если протекают 2 реакции, приводящие из одинаковых начальных состояний к разным конечным состояниям, то разница тепловых эффектов этих реакций будет равна тепловому эффекту перехода одного конечного состояния в другое
2H2(г) + O2(г) = 2H2O(Ж); Q = -285 кДж
2H2(г) + O2(г) = 2H2O(г); Q = -242 кДж
№5. Если протекают 2 реакции, из разных начальных состояний приводящие к одинаковым конечным, то разница тепловых эффектов этих реакций будет равна тепловому переходу одного начального состояния в другое
C(уголь) + O2 = CO2(г); Q = 393 кДж
C(графит) + O2 = CO2(г); Q = 409 кДж
Применение I закона термодинамики к живым организмам
• Живой организм – открытая система
• Энергия не продуцируется организмом, а выделяется при окислении питательных веществ
• Энергия пищи накапливается в организме постепенно в виде химической энергии макроэргических связей (АТФ и др.), а не в виде теплоты
• По мере необходимости энергия макроэргических связей расходуется на совершение всех видов работ
Виды работ в организме
• Сокращение мышечных волокон
• Активный перенос веществ через клеточные мембраны
• Химическая работа по синтезу органических соединений, входящих в состав тканей организма
 2018-01-21
2018-01-21 1217
1217