УРОК 5
Тема. Молярна маса
Цілі уроку: увести поняття «молярна маса»; ознайомити з одиницею вимірювання молярної маси речовини; показати фізичний зміст молярної маси речовини; пояснити взаємозв'язок між кількістю речовини, масою, молярною масою.
Тип уроку: комбінований.
Форми роботи: керована практика, самостійна робота.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва.
ХІД УРОКУ
І. Організація класу
II. Перевірка домашнього завдання
Керована практика. Розв’язання задач
Задача 1

2) За формулою  = N/NA;
= N/NA;
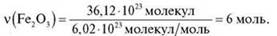
Відповідь: 6 моль.
Задача 2

2) Оскільки в молекулі FeO одна молекула Феруму, то
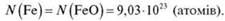
Відповідь: 9,03 · 1023 атомів.
III. Вивчення нового матеріалу
Скільки важить 1 моль речовини?
В 1 моль міститься 6,02 · 1023 частинок речовини. Кожна частинка має певну масу.
Молярна маса — це маса 1 моль речовини, а отже, сумарна маса всіх частинок, що входять в 1 моль цієї речовини.
Молярна маса пропорційна масі однієї молекули певної речовини. Тому числове значення молярної маси дорівнює відносній молекулярній масі для будь-якої речовини.
Молярна маса — це фізична величина, що дорівнює відношенню маси речовини до відповідної кількості речовини.
Позначається Мm.
Mm = m/v.
Одиниці вимірювання: кг/моль або г/моль.
Наприклад, маса 1 моль води дорівнює:
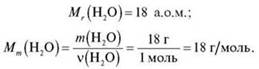
IV. Закріплення вивченого матеріалу
Знаючи масу речовини, ми можемо обчислити кількість речовини за формулою
v = m/Мm.
Задача 1
Обчисліть кількість речовини кисню в 64 г кисню.
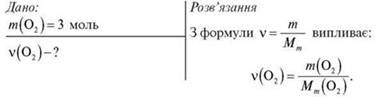
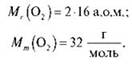
Тоді:
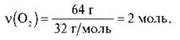
Відповідь: 2 моль.
Задача 2
Обчисліть масу 3 моль карбон(ІV) оксиду.
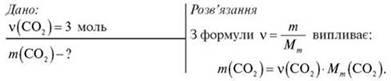
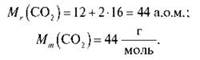
Тоді:
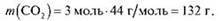
Відповідь: 32 г.
V. Самостійна робота з взаємоперевіркою
Обчисліть масу 5 моль:
варіант І: натрій хлориду NaCl;
варіант II: кальцій оксиду СаО.
Після виконання завдання учні обмінюються роботами й перевірять один одного.
VI. Домашнє завдання
Опрацювати відповідний параграф підручника, відповісти на питання, виконати вправи.
Творче завдання (домашня практика)
1. Обчисліть кількість речовини питної соди — натрій гідрогенкарбонату NaHCO3, в ложці соди масою 42 г.
2. Обчисліть масу 5 моль цукру (сахароза має формулу С12Н22О11).
Узагальнення за темою «Кількість речовини. Молярна маса.»
Цілі і завдання уроку:
1. узагальнити і систематизувати знання з теми " Кількість речовини. Молярна маса."; продовжити формування умінь грамотно викладати свої думки, домагатися узагальненості, системності, дієвості знань через навчальну діяльність, провести контроль знань учнів з теми "Кількість речовини. Молярна маса.";
2. формування пізнавальної потреби; формування прагнення до глибокого засвоєння знань; виховання акуратності в оформленні та запису задач;
3. розвивати вміння застосовувати знання на практиці; логічне мислення учнів; вміння аналізувати умови; вміння працювати у належному темпі, організованість.
Тип уроку: закріплення і узагальнення пройденого матеріалу (з використанням інтерактивного обладнання).
Обладнання уроку: комп'ютери, мультимедійний проектор, екран або інтерактивна дошка, презентація до уроку, кольорові самоклеючі картки.
Підготовка до уроку та оформлення кабінету: підготувати тест для комп'ютера.
Хід уроку:
...може власних Платонов
І швидких разумов Невтонів
Російська земля народжувати.
Ломоносов М.
I. Організаційний момент.
Оголошення мети і завдань уроку.
Вчитель:
Здрастуйте, хлопці! урок ми проведемо у формі уроку-узагальнення з теми " Кількість речовини. Молярна маса."
II. Основна частина уроку.
1. Перегляд презентації: узагальнення за темою " Кількість речовини. Молярна маса " з елементами бесіди і фронтальним опитуванням (10 хвилин).
Фронтальний опитування учнів:
1. Що таке неметали?
Хімічні елементи, які утворюють у вільному стані прості речовини, що не володіють фізичними і хімічними властивостями металів.
2. Що таке алотропія?
Алотропія, властивість деяких хімічних елементів, що дозволяє їм існувати у двох або більше різних фізичних формах.
3. Приклади аллотропов?
Приклади аллотропов: молекулярний кисень і озон; білий і жовтий фосфор; графіт і алмаз (вуглець). Вуглець може існувати у двох формах - графіту і алмазу, які відомі як аллотропы вуглецю.
4. Що таке хімія?
Хімія - це наука про речовини, їхні властивості і перетворення.
5. Що показує відносна атомна маса, як позначається?
Відносна атомна маса елемента - це величина, що показує, у скільки разів маса його атома більше 1/12 маси атома вуглецю.
Відносна атомна маса позначається: Ar
6. Як позначається відносна молекулярна маса, як знайти її значення?
Відносна молекулярна маса - це маса молекули, соотнесенная до 1 а.е.м.
Відносна молекулярна маса позначається: Мг
7. Завдання:
Подумайте, в чому зручніше вимірювати речовини?
Давайте залишимо поки хімію і уявимо, що у нас є купа картоплі. Як нам зручніше перерахувати її? Звичайно мішками.
В 1 мішку - 6 *1023 картоплин, а мішків 20 штук, тоді кількість картоплі ми знайдемо помноживши кількість мішків на кількість картоплин 1 мішку:
N = 20 мішків * 6 *1023 картоплин = 120 * 1023 картоплин
Для підрахунку кількості речовини, користуються не мішками, а такою одиницею вимірювання як МІЛЬ. І в 1 моль речовини містить 6 *1023 частинок цієї речовини.
8. ЩО ТАКЕ МОЛЬ?
МОЛЬ - ЦЕ ТАКА КІЛЬКІСТЬ РЕЧОВИНИ, В ЯКОМУ МІСТИТЬСЯ
6 * 1023 ЧАСТИНОК (молекул або атомів) ЦІЄЇ РЕЧОВИНИ.
9. Чому одно постійна Авогадро?
Постійна Авогадро
(Nа = 6 •1023)
- число постійне і названо на честь італійського вченого Амедео Авогадро
10. Як знайти число молекул речовини в певній кількості речовини?
Тема
· Обчислення об’єму газу за нормальних умов.
Мета уроку
· навчитись обчислювати за хімічною формулою об’єм газу за нормальних умов.
Задачі уроку
1. Згадати значення поняття «молярний об’єм газу», називати хімічну формулу його знаходження.
2. Навчитись вирішувати задачі на знаходження молярного об’єму газу за нормальних умов.
Хід уроку
Поняття «молярний об’єм газу»
Маса одного моля речовини називається молярною. А як називатиметься об'єм одного моля речовини? Очевидно, що і він також називатиметься молярним. Чому дорівнює молярний об'єм води? Коли ми відміряли 1 моль води, ми не зважували на вагах 18 г води — це дуже незручно. Ми користувалися мірним посудом: циліндром, мензуркою або колбою, оскільки знали, що щільність води (маса однієї одиниці об'єму) рівна 1 г/мл. Тому молярний об'єм води рівний 18 мл. У рідин і твердих речовин він залежить від щільності речовин.
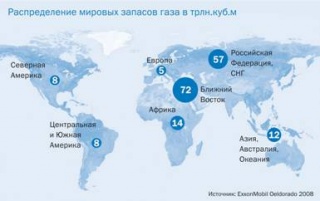
Малюнок 1. Розподіл світових запасів газу.
Інша справа у газів.
Якщо узяти 1 моль водню Н2 (2 г), 1 моль кисню 02 (32 г), 1 моль озону 03 (48 г), 1 моль вуглекислого газу С02 (44 г) і навіть 1 моль водяної пари Н20 (18 г) за однакових умовах, наприклад нормальних (у хімії прийнято називати нормальними умовами температуру 0 °С і тиск 760 мм рт. ст., або 101,3 кПа), то виявиться, що один моль будь-який з газів займе один і той же об'єм, рівний 22,4 л.
На цьому відео ми побачимо як залежить тиск газу від об’єму газу.
Подивіться на Малюнок 1. На ньому зображено сонце. Сонце - виключно величезна куля вируючого газу, переважно водню.

Малюнок 2. Сонце.
Оскільки це об'єм газу кількістю речовини 1 моль, то він називається молярним об'ємом і позначається Vm.
Молярний об’єм – це фізична величина, що дорівнює відношенню об’єму газу до відповідної кількості речовини цього газу.
Vm= V/n; [V]=л, [n]=моль, отже [Vm]= л/моль.
Знаючи молярний об’єм газу, можна визначати кількість речовини, об’єм будь-якої кількості речовини та кількість структурних частинок в певному об’ємі газу.
З формули Vm=V/n → n=V/Vm, або n=V/22,4.
Знаючи, що N= NA∙n, можемо записати: N= NA∙V/22,4.
 2018-01-21
2018-01-21 1007
1007







