1. Какие процессы называют самопроизвольными? Приведите примеры самопроизвольных процессов, в том числе химических реакций.
Самопроизвольный процесс – это свойство процесса быть энергетически выгодным и, следовательно, способным протекать в прямом направлении.
Примерами таких реакций может быть растворение соли в воде, смешение двух газов.
2. Почему условие D H < 0 не может быть критерием самопроизвольного течения химических реакций? Почему самопроизвольно протекают некоторые эндотермические реакции, например, растворение в воде солей KCl или NH4NO3? Что является движущими силами самопроизвольного процесса?
Самопроизвольность процесса – его свойство быть энергетически выгодным и, следовательно, способным протекать в прямом направлении.
Изменение энтальпии системы не может служить единственным критерием самопроизвольного осуществления химической реакции, поскольку многие эндотермические процессы протекают самопроизвольно.
Чтобы сказать, возможно ли самопроизвольное протекание реакции, необходимо ввести такую функцию состояния, как энтропия.
При растворении жидких и твердых веществ энтропия системы обычно возрастает (ΔS > 0), так как растворяемые вещества из более упорядоченного состояния переходят в менее упорядоченное.
Самопроизвольное протекание эндотермической реакции возможно лишь тогда, когда она сопровождается значительным увеличением энтропии.
Существует две движущие силы самопроизвольного протекания процесса:
Стремление уменьшить энергосодержание системы и выделить теплоту (Δ H < 0).
Стремление частиц к хаотичному движению, а системы – к переходу в менее упорядоченное состояние.
3. Сформулируйте 2-ой закон термодинамики для изолированных систем. Почему химические реакции обычно сопровождаются изменением как энтропии, так и энтальпии?
В любой изолированной системе с течением времени происходит постоянное возрастание степени беспорядка, то есть энтропии
Если в системе протекает химическая реакция, то система обменивается энергией с окружающей средой, т.е. не является изолированной. Химические реакции обычно сопровождаются изменением как энтропии, так и энтальпии.
Таким образом, движущая сила процесса складывается из двух сил: стремления к упорядочению (Н) и стремления к беспорядку (TS).
При р = const и Т = const общую движущую силу процесса, которую обозначают G, можно найти из соотношения
∆G=∆H-T∆S
величина G называется изобарно-изотермическим потенциалом или энергией Гиббса.
4. Что такое энтропия и как она связана с термодинамической вероятностью данного состояния? Приведите уравнение Больцмана и укажите, что означает в этом уравнении каждая из величин? Какова размерность энтропии?
Энтропия - это мера неупорядоченности состояния системы; стремление частиц (молекул, ионов) к хаотическому движению.
Соотношение S = kblnW часто называют “уравнением Больцмана“, хотя оно выведено М.Планком в 1900 г. В нем W – число различных состояний системы, доступное ей при данных условиях, или термодинамическая вероятность макросостояния системы.
5. Сформулируйте 3 -е начало термодинамики (постулат М.Планка).
Третье начало термодинамики (теорема Нернста) — физический принцип, определяющий поведение энтропии при приближении температуры к абсолютному нулю. Является одним из постулатов термодинамики, принимаемым на основе обобщения значительного количества экспериментальных данных.
Является ли энтропия функцией состояния системы? Как можно рассчитать изменение энтропии химической реакции? Приведите пример. Что отличает энтропию от других термодинамических функций?
Энтропия — функция состояния системы, равная в равновесном процессе количеству теплоты, сообщённой системе или отведённой от системы, отнесённому к термодинамической температуре системы.
Изменение энтропии химического процесса, согласно закону Гесса, равно разности между энтальпиями образования продуктов реакции и энтальпиями образования исходных веществ.
Пример:
Используя справочные данные, рассчитать изменение энтропии при полном окислении 1 моль глюкозы:
C6H12O6(к) + 6O2(г) = 6CO2(г) + 6H2O(ж)
В данной реакции энтальпия образования кислорода (как простого вещества) равна нулю. Необходимо составить уравнение для вычисления изменения энтропии, подставляем данные и решаем.
В отличие от других термодинамических функций энтропия идеально кристаллического тела при абсолютном нуле равна нулю (постулат Планка).
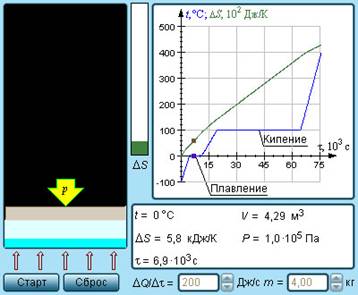
Приведите примеры реакций и процессов, при которых бы энтропия системы увеличивалась, уменьшалась или же оставалась без изменений. Как изменяется энтропия системы при изменении температуры и почему? Покажите эти изменения на диаграмме фазовых переходов воды из твердого состояния в газообразное.
Энтропия увеличивается, когда жидкость изменяет состояние на газообразное при потреблении большего количества тепловой энергии.
Энтропия уменьшается, когда система совершает обратимый процесс и при этом отдает тепло.
Энтропия остается постоянной, когда замкнутая система совершает обратимый процесс.
В процессе плавления (кристаллизации) температура системы остается постоянной до тех пор, пока вся система не расплавится.
В процессе фазового перехода «жидкость – газ» температура остается постоянной и равной температуре кипения до тех пор, пока вся система не перейдет из одной фазы в другую.
 2018-01-21
2018-01-21 1742
1742
