Коллоквиум №2: «Введение в химическую термодинамику и химическую кинетику».
Введение в химическую термодинамику.
1.1. Основные понятия и определения химической термодинамики. 1-ое начало (закон) термодинамики.
- Что является предметом изучения химической термодинамики?
Основным предметом исследования термодинамики является система.
2. Дайте определение понятиям: термодинамическая система, окружающая среда, реагенты, продукты? Какие существуют виды т/д систем? Что их отличает? Приведите примеры различных систем.
Термодинамическая система – некая физическая система, состоящая из большого количества частиц, способная обмениваться с окружающей средой энергией и веществом.
Окружающая среда – часть материального мира, не являющаяся системой.
Реагенты – вещества, вступающие в процесс химического взаимодействия.
Продукты – вещества, образующиеся в конце процесса химического взаимодействия.
Типы систем:
а) Система открытая, если возможен обмен энергией и веществом.
б) Система закрытая, если обмен энергией возможен, а обмен веществом невозможен.
Закрытые системы дополнительно подразделяются по признаку возможности осуществления энергообмена следующим образом:
а) Система замкнутая, если энергообмен возможен, но работа над системой не совершается.
б) Система адиабатная, если полностью отсутствует энергообмен системы с окружающей средой.
в) Система изолированная, если невозможен обмен системы с окружающей средой ни энергией, ни веществом.
3. Что понимают под параметрами термодинамическойсистемы? Перечислите их. Какие параметры называют экстенсивными, а какие интенсивными?
Термодинамические параметры - физические величины, характеризующие равновесное состояние термодинамической системы.
Экстенсивные параметры (пропорциональные объёму (или массе) системы):
а) внутренняя энергия U
б) энтропия S,
в) энтальпия Н,
г) свободная энергия F (Гельмголъцаэнергия)
д) энергия Гиббса G
Интенсивные (не зависящие от массы системы)
а)температура Т
б) давление Р
в) концентрация С,
г) хим. потенциал 
4. Что понимают под термодинамическим процессом? Какие процессы называют изобарными, изохорными, изотермическими, изобарно-изотермическими, обратимыми и необратимыми? Что их отличает?
Термодинамический процесс — изменение макроскопического состояния термодинамической системы.
Изобарный процесс — термодинамический процесс, происходящий в системе при постоянном давлении и постоянной массе идеального газа.
Изохорный процесс — термодинамический процесс, который происходит при постоянном объёме. Для осуществления изохорного процесса в газе или жидкости достаточно нагревать (охлаждать) вещество в сосуде, который не изменяет своего объёма.
Изотермический процесс — термодинамический процесс, происходящий в физической системе при постоянной температуре.
Обратимый процесс — термодинамический процесс, который может проходить как в прямом, так и в обратном направлении, проходя через одинаковые промежуточные состояния, причем система возвращается в исходное состояние без затрат энергии, и в окружающей среде не остается макроскопических изменений.
Необратимый - процесс, который нельзя провести в противоположном направлении через все те же самые промежуточные состояния. Все реальные процессы необратимы.
5. Какие формы обмена энергией между системой и окружающей средой или между системами рассматривает термодинамика? Приведите их символы, дайте соответствующие определения.
6. Что является термодинамическими характеристиками веществ и химических реакций? Что означает понятие функция состояния системы? Какие функции состояния Вы знаете? Как их обозначают? От чего они зависят?
7. Что называют внутренней энергией системы? Почему в термодинамических расчетах используют не абсолютные значения внутренней энергии U, а ее изменения DU при переходе системы из одного состояния в другое?
Внутренняя энергия системы - сумма энергий молекулярных взаимодействий и тепловых движений молекулы.
Абсолютное значение внутренней энергиине может быть найдено из опыта.
Абсолютные значения внутренних энергийи энтальпий индивидуальных веществ неизвестны, однако это не имеет значения, так как внутренние энергии и энтальпии можно отсчитывать от любого уровня, одинакового для исходных веществ и продуктов реакции. Тогда величины _ и U, характеризующие начало отсчета, будут исключены из окончательного результата, поскольку в левой и правой частях уравнения реакции находится одинаковое число атомов, из которых состоят реагирующие вещества.
8. Сформулируйте первое начало (закон) термодинамики. Приведите математическое выражение этого закона для изохорного и для изобарного процессов.
Первое начало термодинамики представляет собой формулировку обобщённого закона сохранения энергии для термодинамических процессов. В наиболее простой форме его можно записать как 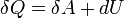
Количество теплоты, полученное системой, идёт на изменение её внутренней энергии и совершение работы против внешних сил.
9. Дайте определение следующим понятиям: внутренняя энергия, энтропия, теплота, работа. Какие из этих величин относятся к функциям состояния? Почему?
Внутренняя энергия тела (обозначается как E или U) — это сумма энергий молекулярных взаимодействий и тепловых движений молекулы. Внутренняя энергия является однозначной функцией состояния системы. Это означает, что всякий раз, когда система оказывается в данном состоянии, её внутренняя энергия принимает присущее этому состоянию значение, независимо от предыстории системы. Следовательно, изменение внутренней энергии при переходе из одного состояния в другое будет всегда равно разности между ее значениями в конечном и начальном состояниях, независимо от пути, по которому совершался переход.
Энтропия — в естественных науках мера беспорядка системы, состоящей из многих элементов.
Теплота сгорания — количество выделившейся теплоты при полном сгорании массовой (для твердых и жидких веществ) или объёмной (для газообразных) единицы вещества.
Работа – форма передачи энергии от одной системы к другой, или от системы к ее окружению.
10. Что понимают под энтальпией химической реакции? В каких единицах измеряется? От чего зависит ее величина?
Энтальпия,— термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц.
Проще говоря, энтальпия — это та энергия, которая доступна для преобразования в теплоту при определенных температуре и давлении.
Энтальпия измеряется - кДж/моль.
энтальпия реакции - это разность между суммой энтальпий образования продуктов реакции и суммой энтальпий образования реагентов с учетом стехиометрических количеств веществ
| ΔH = ∑(nΔH)продукты - ∑(nΔH)реагенты |
Изменение энтальпии не зависит от пути процесса, зависит только начального и конечного состояния системы.
11. Что понимают под энергией Гиббса химической реакции? В каких единицах измеряется? От чего зависит ее величина?
Энергия Гиббса — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на вопрос о принципиальной возможности протекания химической реакции.
Это термодинамический потенциал следующего вида:
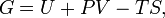
Измеряется в Джоулях.
1.2. Термохимия. Тепловые эффекты химических реакций. Закон Гесса.
1. Что такое термохимия? Что она изучает? Какой закон термохимии называется основным? Каковы следствия из него? Дайте формулировки и приведите примеры их использования на практике.
Термохимия - раздел химической термодинамики, изучающий тепловые эффекты химических реакций и фазовых превращений.
Теплота равная термодинамическим функциям состояния сама является термодинамической функцией состояния и, следовательно, не зависит от пути процесса, а зависит только от начального и конечного состояния системы. Этот закон был установлен в 1841 г. русским акад. Г.И. Гессом.
Закон Гесса — основной закон термохимии, который формулируется следующим образом: Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
а)тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции (закон Лавуазье — Лапласа).
б)тепловой эффект химической реакции равен разности сумм теплот образования (ΔHf) продуктов реакции и исходных веществ, умноженных на стехиометрические коэффициенты (ν):
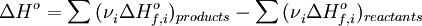
в)тепловой эффект химической реакции равен разности сумм теплот сгорания (ΔHc) исходных веществ и продуктов реакции, умноженных на стехиометрические коэффициенты (ν):
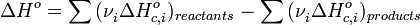
2. Сформулируйте закон Гесса. Какие следствия из него вытекают? Для каких определений они используются в термохимических расчетах?
Закон Гесса — основной закон термохимии, который формулируется следующим образом: Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
а)тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции (закон Лавуазье — Лапласа).
б)тепловой эффект химической реакции равен разности сумм теплот образования (ΔHf) продуктов реакции и исходных веществ, умноженных на стехиометрические коэффициенты (ν):
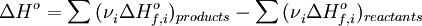
в)тепловой эффект химической реакции равен разности сумм теплот сгорания (ΔHc) исходных веществ и продуктов реакции, умноженных на стехиометрические коэффициенты (ν):
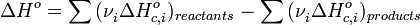
Использование закона Гесса позволяет рассчитать энергию ионной кристаллической решетки при известных значениях энтальпий других стадий процесса.
3. Что называют тепловым эффектом реакции? Как различаются реакции по тепловым эффектам? Как можно проиллюстрировать это с помощью энергетических (энтальпийных) диаграмм? Чем отличается термохимическая и термодинамическая система знаков для тепловых эффектов реакций?
Тепловой эффект химической реакции (изменение энтальпии системы вследствие протекания химической реакции) — отнесенное к изменению химической переменной количество теплоты, полученное системой, в которой прошла химическая реакция и продукты реакции приняли температуру реагентов.
Практически важны два типа тепловых эффектов реакции -изотермо-изобарный и изотермо-изохорный.
В настоящее время наряду с существовавшей ранее термохимической шкалой широко используется термодинамическая шкала, которая учитывает изменение внутренней энергии системы. В термохимической и термодинамической шкале знаки противоположны.
4. В каких случаях уравнения химических реакций называют термохимическими? Почему в них иногда имеются дробные коэффициенты? Какие операции можно совершать с термохимическими уравнениями отдельных стадий процесса?
Термохимические уравнения реакций - это уравнения, в которых около символов химических соединений указываются агрегатные состояния этих соединений или кристаллографическая модификация и в правой части уравнения указываются численные значения тепловых эффектов.
Если теплоту реакции отнести к 1 моль определенного вещества, то в термохимическом уравнении некоторые стехиометрические коэффициенты могут быть дробными.
Используя закон Гесса и следствия из него и производя различные алгебраические действия с термохимическими уравнениями реакций, для которых известны тепловые эффекты, можно рассчитывать тепловые эффекты таких реакций, для которых еще е имеется опытных данных.
5. Что называют энтальпией химической реакции? Как ее можно рассчитать? Почему при расчетах энтальпий реакций пользуются стандартными энтальпиями образования веществ?
Энтальпия (тепловая функция, теплосодержание) — термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц. Энтальпия — это та энергия, которая доступна для преобразования в теплоту при определенных температуре и давлении.
Зная свободную энергию и энтропию, можно вычислить энтальпию. Свободная энергия, или энергия Гиббса, представляет собой часть энтальпии системы, затраченную на превращение в работу, и равна разности энтальпии и температуры, умноженной на энтропию:
ΔG=ΔH-TΔS (ΔH, ΔG, ΔS - приращения величин)
Энтальпия также рассчитывается исходя из уравнения химической реакции. Если дано уравнение химической реакции вида A+B=C, то энтальпию можно определить по формуле: dH=dU+ΔnRT, где Δn=nk-nн (nk и nн - число молей продуктов реакции и исходных веществ)
При изобарном процессе энтропия равна изменению теплоты в системе: dq=dH.
При постоянном давлении энтальпия равна: H=∫СpdT
В случае, если энтальпийный и энтропийный факторы уравновешивают друг друга, приращение энтальпии равно произведению температуры на приращение энтропии: ΔH=TΔS
Обычно пользуются стандартными изменениями энтальпии, так как большинство реакций протекает при постоянном давлении, а в этом случае тепловой эффект реакции равен изменению энтальпии.
6. Какие условия состояния системы принимают в термодинамике в качестве стандартных? Какими символами их обозначают?
Стандартные состояния — в химической термодинамике условно принятые состояния индивидуальных веществ и компонентов растворов при оценке термодинамических величин.
Для газовой фазы — это (предполагаемое) состояние химически чистого вещества в газовой фазе под стандартным давлением 100 кПа (до 1982 года — 1 стандартная атмосфера, 101 325 Па, 760 мм ртутного столба), подразумевая наличие свойств идеального газа.
Для беспримесной фазы, смеси или растворителя в жидком или твёрдом агрегатном состоянии — это состояние химически чистого вещества в жидкой или твёрдой фазе под стандартным давлением.
Для раствора — это (предполагаемое) состояние растворённого вещества со стандартной моляльностью
1 моль/кг, под стандартным давлением или стандартной концентрации, исходя из условий, что раствор неограниченно разбавлен.Для химически чистого вещества — это вещество в чётко определённом агрегатном состоянии под чётко определённым, но произвольным, стандартным давлением.
7. Что такое стандартное состояние вещества? Что понимают под стандартными энтальпиями образования веществ? В каких единицах выражают? Где приводятся эти величины? Какую информацию они могут дать?
Стандартные состояния — в химической термодинамике условно принятые состояния индивидуальных веществ и компонентов растворов при оценке термодинамических величин.
Стандартные энтальпии образования соответствуют реакциям образования, при которых и простые вещества, и получающееся соединение находятся при давлении 1 атм (1,01 x 105 Па). По определению, для всех простых веществ при любой температуре. Для большинства хим. соединений энтальпия образования- отрицательные величины.
Единицы измерения энтальпии образования - Дж/г, Дж/моль
 2018-01-21
2018-01-21 1308
1308