К поверхностным явлениям относятся процессы, происходящие на границе раздела фаз; они обусловлены особенностями состава и структуры поверхностей.
Образование поверхности раздела фаз требует совершения работы, следовательно, оно сопровождается увеличением свободной энергии системы. В поверхностном слое накапливается некоторый избыток энергии - поверхностная энергия Гиббса GS, пропорциональная площади поверхности раздела фаз S:
 где σ - коэффициент поверхностного натяжения, т. е. работа образования единицы поверхности. Коэффициент поверхностного натяжения также численно равен силе, приложенной к единице длины контура, ограничивающего поверхность, и направленной вдоль этой поверхности перпендикулярно контуру (рис. 15.1); dim σ = МТ-2, единица измерения - джоуль на квадратный метр (Дж/м2) или ньютон на метр (Н/м). Следует отметить, что коэффициент поверхностного натяжения часто называют поверхностным натяжением.
где σ - коэффициент поверхностного натяжения, т. е. работа образования единицы поверхности. Коэффициент поверхностного натяжения также численно равен силе, приложенной к единице длины контура, ограничивающего поверхность, и направленной вдоль этой поверхности перпендикулярно контуру (рис. 15.1); dim σ = МТ-2, единица измерения - джоуль на квадратный метр (Дж/м2) или ньютон на метр (Н/м). Следует отметить, что коэффициент поверхностного натяжения часто называют поверхностным натяжением.
Самопроизвольное уменьшение свободной поверхностной энергии GS в однокомпонентных системах возможно только за счет уменьшения площади поверхности раздела фаз. В многокомпонентных системах уменьшение GS возможно также за счет уменьшения величины поверхностного натяжения в результате самопроизвольного перераспределения молекул компонента между объемом фазы и поверхностью раздела. Это явление называется адсорбцией.
|
|
|
Уравнение Гиббса: 2) 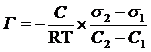 относительная адсорбция на подвижных поверхностях раздела фаз (уравнение Гиббса)
относительная адсорбция на подвижных поверхностях раздела фаз (уравнение Гиббса)
8) Поверхностно-активные вещества (ПАВ) — химические соединения, которые, концентрируясь на поверхности раздела фаз, вызывают снижение поверхностного натяжения.
Первым и самым популярным ПАВ, которому уже многие тысячи лет, является мыло. И ежегодно, несмотря на конкуренцию новых моющих и чистящих средств, сперва на основе алкилбензолсульфоната, а теперь и других, в мире потребляется более 9 млн. т. мыла. Именно мыло остается наиболее распространенным в мире ПАВ.
Благодаря моющим, смачивающим, эмульгирующим, диспергирующим и другим ценным свойствам ПАВ находят широкое применение в производстве моющих и чистящих средств, косметических и фармацевтических препаратов. А также для производства латекса, каучука, полимеров, в добыче, транспортировке и переработке нефти и др.
Пав- ы - это химические чистящие, моющие, а также средства защиты растений, текстиля, кожи и бумаги, строительных материалов, ингибиторов коррозии. Большая часть ПАВ (порядка 60 %) приходится на производство моющих средств (СМС - синтетические моющие средства).
Основным сырьем для производства ПАВ служат продукты нефтепереработки и нефтехимического синтеза: низкомолекулярные и высшие парафины, олефины, синтетические жирные кислоты, высшие жирные спирты, алкилпроизводные бензола и фенола и др.
|
|
|
Правило Траубе — зависимость, связывающая поверхностную активность водного раствора органического вещества с длиной углеводородного радикала в составе его молекулы. Согласно этому правилу, при увеличении длины углеводородного радикала на одну группу СΗ2 поверхностная активность вещества увеличивается в среднем в 3,2 раза[1].
Поверхностная активность зависит от строения молекул ПАВ; последние обычно состоят из полярной части (группы, обладающие большим дипольным моментом) и неполярной части (алифатические или ароматические радикалы). В границах гомологического ряда органических веществ, концентрация, необходимая для понижения поверхностного натяжения водного раствора до определённого уровня, снижается в 3-3,5 раза при увеличения углеродного радикала на одну -СΗ2-группу.
Правило было сформулировано И. Траубе (нем.)русск. в 1891 году[2] в результате его опытов, проведённых на растворах множества веществ (карбоновые кислоты, эфиры, спирты, кетоны) в воде.
9) Пове́рхностное натяже́ние — термодинамическая характеристика поверхности раздела двух находящихся в равновесии фаз, определяемая работой обратимого изотермокинетического образования единицы площади этой поверхности раздела при условии, что температура, объём системы и химические потенциалы всех компонентов в обеих фазах остаются постоянными.
Существуют два типа методов определения поверхностного натяжения: статические и динамические.
Динамические методы, например метод колебания струи, вытекающей из отверстия неправильной формы, позволяют измерить поверхностное натяжение вновь образованной поверхности сразу после ее образования. Статическими методами измеряют поверхностное натяжение на границе раздела фаз, пришедших в равновесие. Если равновесие между фазами устанавливается достаточно быстро, то статическое поверхностное натяжение можно измерить достаточно просто. Если же равновесие устанавливается за очень длительный промежуток времени, особенно при переходе одного из компонентов системы через границу раздела фаз, то ни один из методов не дает истинного значения равновесногоповерхностного натяжения. В этом случае говорят о полустатических значениях поверхностного натяжения и в обязательном порядке следует оговаривать продолжительность образования новой поверхности раздела фаз.
Наибольшее распространение получили следующие методы определения поверхностного натяжения жидких межфазовых границ:
· метод измерения массы или глубины погружения предмета в исследуемую жидкость (метод Вильгельми);
· метод измерения геометрических размеров свободных поверхностей раздела фаз (лежащая, висящая или вращающаяся капля, сидящий или висящий пузырек);
· сталагмометрический метод (метод счета капель);
· метод измерения усилия отрыва предмета от поверхности раздела фаз (отрыва цилиндра - метод Падди, отрыва кольца - метод Дю-Нуи);
· метод измерения капиллярного поднятия жидкости;
· метод измерения максимального давления в пузырьке газа или капле жидкости (метод Шредингера).
10) Твердые адсорбенты - это природные и искусственные материалы с большой наружной или внутренней поверхностью, на которой происходит адсорбция из граничащих с ней газов или растворов.
В зависимости от интенсивности силового поля на поверхности адсорбента и под влиянием различных внешних условий могут образовываться адсорбционные слои толщиной в одну молекулу (мономолекулярная адсорбция) или в несколько молекул (полимолекулярная адсорбция).
|
|
|
Адсорбция на границе твердое тело - раствор сложна из-за физической неоднородности поверхности твердых тел.(наличием дефектов поверхности - трещин, дислокаций, выходом разных граней кристалла на поверхность и так далее).
Кроме того, адсорбция из растворов на твердом адсорбенте осложняется наличием третьего компонента - растворителя, молекулы которого могут также адсорбироваться на поверхности адсорбента.
Чем хуже адсорбируется растворитель на адсорбент, тем лучше адсорбция растворенного вещества.
Так как для твердых адсорбентов отсутствуют достаточно точные методы непосредственного определения поверхностного натяжения, уравнения Гиббса для них не применимо. В большинстве случаев невозможно непосредственно определить удельную поверхность твердого адсорбента, поэтому используют в основном эмпирические зависимости.
Мерой адсорбционной энергии может служить теплота адсорбции. Известно, что при адсорбции уксусной кислоты на угле теплота адсорбции падает с увеличением степени заполнения по экспоненте, то есть поверхность угля при адсорбции на ней уксусной кислоты является экспоненциально неоднородной.
11) АДСО́РБЦИЯ (от лат. ad — на, при и sorbeo — поглощаю), поглощение какого-либо вещества (адсорбата) из газообразной среды или раствора поверхностным слоем жидкости или твердого тела (адсорбентом). Различают два вида адсорбции: физическую и химическую (хемосорбцию). Менее прочная физическая адсорбция не сопровождается существенными изменениями молекул адсорбата. Она обусловлена силами межмолекулярного взаимодействия, которые связывают молекулы в жидкостях и некоторых кристаллах и проявляются в поведении сильно сжатых газов. Существенное отличие физической адсорбции — ее обратимость. При хемосорбции молекулы адсорбата и адсорбента образуют химические соединения. Часто адсорбция обусловлена и физическими и химическими силами, поэтому не существует четкой границы между физической адсорбцией и хемосорбцией.
12) Адсорбция из водных растворов электролитов происходит, как правило, таким образом, что на твердом адсорбента из раствора адсорбируются преимущественно ионы одного вида. Преимущественная адсорбция из раствора или аниона, или катиона определяется природой адсорбента и ионов. Механизм адсорбции ионов из растворов электролитов может быть различным; выделяют обменную и специфическую адсорбцию ионов.
|
|
|
Обменная адсорбция представляет собой процесс обмена ионов между раствором и твердой фазой, при котором твердая фаза поглощает из раствора ионы какого-либо знака (катионы либо анионы) и вместо них выделяет в раствор эквивалентное число других ионов того же знака. Обменная адсорбция всегда специфична, т.е. для данного адсорбента к обмену способны только определенные ионы; обменная адсорбция обычно необратима.
При специфической адсорбции адсорбция на поверхности твердой фазы ионов какого-либо вида не сопровождается выделением в раствор эквивалентного числа других ионов того же знака; твердая фаза при этом приобретает электрический заряд. Это приводит к тому, что вблизи поверхности под действием сил электростатического притяжения группируется эквивалентное число ионов с противоположным зарядом, т.е. образуется двойной электрический слой. Взаимодействие концентрирующихся на поверхности зарядов приводит к понижению поверхностной энергии системы. Для случая специфической адсорбции электролита Песковым и Фаянсом было сформулировано следующее эмпирическое правило (правило Пескова – Фаянса):
На поверхности кристаллического твердого тела из раствора электролита специфически адсорбируется ион, который способен достраивать его кристаллическую решетку или может образовывать с одним из ионов, входящим в состав кристалла, малорастворимое соединение.
Адсорбируются из раствора растворенные вещества. Величина адсорбции для растворов является функцией температуры и молярной концентрации раствора
Величина адсорбции становится функцией молярной концентрации раствора
Адсорбция из растворов имеет существенные отличия от газовой адсорбции. Это вызвано следующими причинами:
- на адсорбенте может адсорбироваться не только растворенное вещество, но и сам растворитель. Чем лучше протекает адсорбция растворителя, тем труднее будет адсорбироваться растворенное вещество;
- растворитель может растворять адсорбент. Чем лучше растворитель растворяет адсорбент, тем труднее протекает на нём адсорбция;
- скорость адсорбции из раствора зависит от скорости диффузии.
В результате обеднения извлекаемым веществом слоев воды, прилежащих к адсорбенту, дальнейшая адсорбция определяется скоростью диффузии поглощаемого вещества к адсорбенту. Как известно, диффузия в жидкостях достаточно медленный процесс, поэтому для ускорения адсорбции прибегают к перемешиванию раствора.
На зависимость адсорбции от продолжительности процесса влияет и молекулярно-весовое распределение полимера, так как коэффициент диффузии зависит от концентрации и молекулярного веса
13) поглощение вещества из газовой или жидкой среды поверхностным слоем твердого тела (адсорбента) или жидкости. Адсорбция применяется во многих отраслях медицины (лабораторные исследования, анестезиология и реаниматология, токсикология и др.), а также является одним из свойств кожи и слизистых оболочек.
14) Хроматогра́фия (от др.-греч. χρῶμα — цвет) — динамический сорбционный метод разделения и анализа смесей веществ, а также изучения физико-химических свойств веществ. Основан на распределении веществ между двумя фазами — неподвижной (твердая фаза или жидкость, связанная на инертном носителе) и подвижной (газовая или жидкая фаза, элюент). Название метода связано с первыми экспериментами по хроматографии, в ходе которых разработчик метода Михаил Цвет разделял ярко окрашенные растительные пигменты.
15) Комплексные соединения (лат. complexus — сочетание, обхват) или координационные соединения (лат. co — «вместе» и ordinatio — «упорядочение») — частицы (нейтральные молекулы или ионы), которые образуются в результате присоединения к данному иону (или атому), называемому комплексообразователем, нейтральных молекул или других ионов, называемых лигандами. Теория комплексных соединений (координационная теория) была предложена в 1893 г. А. Вернером.
Комплексные соединения, имеющие внешнюю сферу, в водном растворе полностью диссоцируют на комплексный малодиссоцирующийкатион ([Ag(NH3)2]+) или анион ([Fe(CN)6]3−). Комплексные соединения без внешней сферы в воде нерастворимы (например, карбонилы металлов).
Классификация
По заряду комплекса
1) Катионные комплексы образованы в результате координации вокруг положительного иона нейтральных молекул (H2O, NH3 и др.).
[(Zn(NH3)4)]Cl2 — хлорид тетраамминцинка(II)
[Co(NH3)6]Cl2 — хлорид гексаамминкобальта(II)
2) Анионные комплексы: в роли комплексообразователя выступает атом с положительной степенью окисления, а лигандами являются простые или сложные анионы.
K2[BeF4] — тетрафторобериллат(II) калия
Li[AlH4] — тетрагидридоалюминат(III) лития
K3[Fe(CN)6] — гексацианоферрат(III) калия
3) Нейтральные комплексы образуются при координации молекул вокруг нейтрального атома, а также при одновременной координации вокруг положительного иона — комплексообразователя отрицательных ионов и молекул.
[Ni(CO)4] — тетракарбонилникель
[Pt(NH3)2Cl2] — дихлородиамминплатина(II)
 2018-01-21
2018-01-21 4738
4738
