Теплоємністю тіла називається кількість теплоти, що необхідна для нагрівання його на одиницю температури. Теплоємності різних тіл, навіть якщо вони з однієї і тієї ж речовини, не однакові і залежать від мас тіл. Тому зручно користуватись питомою теплоємністю речовини, яка визначається як кількість теплоти, що необхідна для підвищення температури одиниці маси речовини на один градус (в системі SI - на І К). Кількість теплоти Q, що йде на нагрівання речовини масою m від температури t1 до температури t2, виражається через питому теплоємність c наступним чином:
Q=cm(t2 – t1) (1)
В системі SІ питома теплоємність вимірюється в Дж/(кг∙К).
У теоретичних дослідженнях частіше використовують молярну теплоємність речовини - кількість теплоти, яку потрібно для нагрівання на одиницю температури одного моля (або одного кіломоля) речовини. Таким чином, розглядаються теплоємності таких мас різних речовин, які містять однакову кількість молекул - число Авогадро. Тоді відмінності у теплоємностях будуть відбивати відмінності в будові молекул і в характері міжмолекулярної взаємодії, тобто будуть відображати відмінності в самій природі речовин, Розмірність молярної теплоємності така ж, як і розмірність універсальної газової сталої R, - R = 8,31 Дж/моль∙К. Молярна теплоємність С пов'язана з питомою теплоємністю с через молярну масу речовини μ
C = μ c (2)
При переході системи з одного стану в інший теплоємність її змінюється. Існують процеси, які називаються політропічними, теплоємність системи в яких залишається сталою. До них відносяться, наприклад, ізобаричні, ізохорні, ізотермічні та адіабатичні процеси. Найбільше поширення здобули теплоємності при сталому тиску (Ср і cр) та при сталому об'ємі (Сυ і cυ). Слід зазначити, що при нагріванні системи в умовах р =const, на відміну від нагрівання в умовах V =const, відбувається не тільки збільшення температури і внутрішньої енергії системи, але й здійснюється робота А на розширення системи
А = 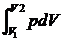 (3)
(3)
тому завжди Cp>Сv (cp>cv). Зокрема для молярних теплоємностей Сp і Сv ідеального газу Сp=Сv+R. Для твердих тіл або рідин, об'єм яких при нагріванні змінюється на незначну величину, приймають
Сp ≈ Сv = С (4)
і говорять просто про молярну теплоємність твердого тіла або рідини.
Виконаємо розрахунок молярної теплоємності кристалічних тіл для випадку, коли у вузлах кристалічної решітки тіла знаходяться одноатомні молекули, тобто для випадку хімічно простих твердих тіл, в структурі яких реалізується атомний або металічний тип зв'язку.
Атоми, що знаходяться у вузлах кристалічної решітки, здійснюють незалежні коливання у трьох взаємно-перпендикулярних напрямках. Вони мають три коливальні ступені свободи - три координати, які відповідають цим коливальним рухам. Згідно закону рівнорозподілу Больцмана, на кожну ступінь свободи системи в стані термодинамічної рівноваги припадає в середньому кінетична енергія, рівна ½∙ kТ, де k = 1,38∙10 -23 Дж/К- стала Больцмана, Т – абсолютна температура. Оскільки коливальний рух пов'язаний з постійним перерозподілом енергії в кінетичну і потенціальну її форми, і має на кожну ступінь свободи вдвічі більшу енергетичну ємність, порівняно з поступальним або обертальним рухами, то на кожну коливальну ступінь свободи приходиться і енергія вдвічі більша, тобто kТ. В цілому на кожний атом кристалічної решітки припадатиме енергія  = 3kТ. Внутрішня енергія U маси m кристалу становитиме
= 3kТ. Внутрішня енергія U маси m кристалу становитиме
U= 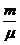 NA
NA  =
= 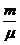 NA ∙3kT, (5)
NA ∙3kT, (5)
де NA =  число Авогадро (NA = 6,05∙1023 1/моль).
число Авогадро (NA = 6,05∙1023 1/моль).
Використовуючи перше начало термодинаміки
Q = ΔU + A, (6)
де Q - кількість теплоти підведена до системи, А - робота системи проти зовнішніх сил при розширенні, ΔU = U2 - U1 - зміна внутрішньої енергії системи, а також рівняння (1)-(5) з врахуванням незначної зміни об'єму системи, а значить і можливістю знехтувати величиною А, одержимо
C = μ c = 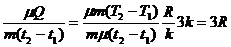 (7)
(7)
- молярна теплоємність всіх хімічно простих тіл в кристалічному стані однакова, незмінна і дорівнює трьом універсальним газовим сталим. Це твердження і є встановлений дослідним шляхом закон Дюлонга-Пті (1819).
В більш загальному випадку, коли тверде тіло є хімічною сполукою, і у вузлах кристалічної решітки знаходяться або молекули, що складаються з кількох атомів (молекулярні кристали), або полярні іони різних хімічних елементів (іонні кристали), справедливий закон Джоуля-Коппа (1864), згідно якому молярна теплоємність твердої сполуки дорівнює сумі молярних (атомних) теплоємностей елементів, з яких вона складається
С = С1 + С2 +...+ Сn = 3 R n, (8)
де n - число атомів в молекулі твердої сполуки.
Тепловий рух у рідинах і твердих тілах має загальний характер - він зводиться до коливального руху молекул поблизу деякого положення рівноваги. Тому закони Дюлонга-Пті і Джоуля-Коппа можуть бути застосовані і для розрахунку молярних теплоємностей рідин. Так, наприклад, молярна теплоємність води точно співпадає з розрахунковою.
Між рідкими і кристалічними тілами є багато спільного. Так в структурі рідин, хоча й не на великих відстанях, спостерігається певна періодичність у розташуванні молекул ("ближній порядок"), рідини, як і тверді тіла, зберігають свій об'єм, при кристалізації рідин їх об'єм практично не змінюється, переохолоджені рідини - аморфні тверді тіла - мають значну твердість та міцність. Теплофізичні і електричні властивості рідин близькі до їх кристалічної фази. Не даремно твердий і рідкий агрегатні стани об'єднують у єдиний термін - конденсований стан речовини.
У ветеринарії та медицині для місцевого нагрівання або охолодження застосовують нагріті чи охолоджені тіла, часто рідини. Для цієї мети вибирають порівняно доступні та ефективні речовини. Щоб протягом тривалого часу бажана дія не згасала, матеріали, що використовуються, повинні мати велику питому теплоємність. До них належать вода, парафін, грязі та ін.
Теплоємності деяких продовольчих продуктів можуть бути використані для оцінки їх якості, наприклад свіжості або жирності.
Питання про теплоємність біологічних об'єктів особливо їх вищих форм, таких як цілісний організм людини чи тварини, надзвичайно складне. Воно пов'язане з здатністю біооб'єктів до саморегуляції, зокрема терморегуляції. Крім того, біологічні об'єкти активно взаємодіють з оточуючим середовищем, що вносить значні ускладнення для визначення теплоємності об'єкта в цілому. Визначення теплоємностей окремих рідин, які є одними з основних структурних модулів організму, не викликає складнощів. Теплоємність біологічних рідин, наприклад крові, корелює з електрофізіологічними властивостями, теплопровідністю, в'язкістю і може бути використана для експресаналізу стану організму.
Теплоємність досліджуваної рідини в даній роботі визначається шляхом порівняння кількості теплоти (енергії), яка витрачається на нагрівання фіксованої маси рідини, і виразу цієї теплоти через теплоємність.
За допомогою електронагрівача температура калориметра підвищується від вихідного початкового її значення t1 до заданого кінцевого значення t2. При достатньо повільному нагріванні температура по всьому об'єму калориметра, а також по всьому об'єму досліджуваної рідини, що заповнює калориметр, однакова. Таке нагрівання здійснюють двічі: спочатку нагрівають порожній калориметр, потім - калориметр з досліджуваною рідиною. Вимірюється час нагрівання τ1 в першому і τ2 в другому випадку.
Рівняння теплового балансу в кожному випадку можна записати відповідно:
Q1 = Qk + q1; Q2 = Qk + Qp + q2, (9)
де Q1 і Q2 кількості теплоти, передані нагрівачем в обох випадках; Qk - кількість теплоти, затрачена на нагрівання калориметра; Qp - кількість теплоти, затрачена на нагрівання досліджуваної рідини; q1 і q2 - втрати теплоти в оточуюче середовище та теплоізоляцію в процесі нагрівання калориметра.
Враховуючи, що нагрівання в обох випадках зручно проводити при однакових потужностях струму в нагрівачу, то за законом Джоуля-Ленца можна записати:
Q1 = I U τ1; Q1 = I U τ2, (10)
де I - сила струму та U - напруга на нагрівальній спіралі. Температура захисного кожуха калориметра під час роботи практично не відрізняється від кімнатної, внаслідок чого можна знехтувати втратами теплоти в оточуюче середовище, тобто вважати q1 і q2, а. тим більше їх різницю (q2 – q1), малими порівняно з кількістю теплоти, затраченої на нагрівання досліджуваної рідини та калориметра. Тоді з (9), (10) та (1) одержимо:
Qp = Q2 – Q1 = I U (τ2 – τ1) = cm (t2- t1) (11)
Вважаючи величину питомої теплоємності досліджуваної рідини с сталою, одержимо лінійну залежність часу нагріванння досліджуваної рідини τ2 від різниці температур (t2- t1):
τ2 – τ1 =c 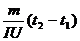 (12)
(12)
Вказана залежність може бути перевірена експериментально, якщо задати декілька послідовних значень t2: (t2)1, (t2)2, (t2)3, … і виміряти відповідні їм значення τ2: (τ2)1, (τ2)2, (τ2)3,... питома теплоємність досліджуваної рідини c визначається з формули (12) з врахуванням графічного усереднення вказаної залежності.
Таким чином, визначення теплоємностей досліджуваних рідин даним методом зводиться до вимірювання часів нагрівання порожнього τ1 і заповненого τ2 калориметра від початкової температури t1 до заданої t2 при фіксованій потужності нагрівання.
Установка для визначення теплоємності рідин складається з калориметра і електронно-вимірювального блока.
Калориметр призначений для нагрівання фіксованого об'єму досліджуваної рідини і являє собою латунний конічний корпус з отвором, куди за допомогою спеціального тонкостінного латунного стакана розміщується досліджувана рідина. Отвір калориметра закривається теплоізолюючою кришкою. На зовнішній поверхні латунного корпусу розміщена нагрівальна спіраль. Корпус калориметра також теплоізольований ззовні.
Для вимірювання температури калориметра в його корпус вмонтований напівпровідниковий датчик. Значення температури реєструються за допомогою цифрового індикатора на електронно-вимірювальному блоці.
Нагрівання спіралі калориметра здійснюється пропусканням через неї постійного струму низької напруги (U≤ 50 В) від джерела струму живлення, розташованого в електронному блоці. Потужність джерела живлення регулюється в межах 0-50 В ручками "Грубо" і "Точно", а також тумблером "Нагрев". Значення напруги і сила струму в колі вимірюється відповідним натисканням клавіш електронно-вимірювального блока і відображаються на цифровому індикаторі.
Час нагрівання калориметра реєструється на цифровому індикаторі, розміщеному на лицьовій панелі електронно-вимірювального блока ліворуч. Секундомір приводиться в дію клавішою "Пуск" (подвійним натисканням) Закінчення відліку часу проводиться натисканням клавіші "Сброс". Подальший пуск секундоміра здійснюється відтисканням клавіші "Сброс".
Конструкція секундоміра передбачає фіксацію значень часу на індикаторі клавішою "Стоп" без зупинки відліку часу. Стирання фіксованих значень часу здійснюється повторним натисканням клавіші "Пуск", після чого на індикаторі продовжується відлік з врахуванням часу на зупинку.
Увага!
Не вмикати електронний блок без підключення кабеля калориметра!
Порядок виконання роботи:
1. Прочитайте інструкцію до лабораторної роботи і уважно ознайомтесь з установкою.
2. Переконайтесь, що тумблери "Сеть" і "Нагрев" вимкнуті, резистори "Грубо" і "Точно" знаходяться в крайньому лівому положенні.
3. З'єднайте кабель, що йде від калориметра, з електронно-вимірювальним блоком, після чого підключіть електронно-вимірювальний блок до мережі, тумблер "Сеть" переведіть в положення "Вкл".
4. Вивчіть методику роботи з секундоміром.
5. Щільно закрийте кришку калориметра разом із порожнім стаканом для досліджуваної рідини і включіть тумблер нагріву. Ручками "Грубо" і "Точно" виставте задану викладачем напругу на нагрівальній спіралі (наближено 20-30 В). Зафіксуйте струм нагріву.
6. Виберіть значення температури t1 (порядка 30°С) і при досягненні цієї температури калориметром включіть секундомір.
7. Проведіть серію вимірювань часу нагрівання порожнього калориметра від вихідної температури t1 до заданої температури t2, причому в якості t2 візьміть декілька (3-6) послідовних значень температури з інтервалом 2-4°С.
8. Після закінчення вимірювань виключить нагрів, відкрийте кришку калориметра і охолодіть калориметр з стаканом нижче вихідної температури t1.
9. Зваживши латунний тонкостінний стакан калориметра, заповніть його досліджуваною рідиною до граничної позначки і знову зважте на терезах. Визначте масу m досліджуваної рідини в стакані.
10. Помістіть заповнений стакан в калориметр. Щільно закрийте кришку калориметра і зачекайте декілька хвилин до вирівнювання температури калориметра і досліджуваної рідини в стакані.,
11. Увімкніть нагрів калориметра при тих же параметрах I і U, як і в випадку порожнього калориметра.
12. При досягненні калориметром температури t1 увімкніть секундомір і проведіть виміри часу нагрівання до тих же значень температури t2, як і в пункті 7.
І3. Після закінчення вимірювань приведіть установку до початкового стану. Результати вимірювань занесіть в таблицю.
14. Побудуйте графік залежності τ2 – τ1 = f(t2 – t1 ) і за середнім нахилом одержаної прямої визначте згідно з формулою (12) коефіцієнт c =  , а з нього і середнє значення питомої теплоємності досліджуваної рідини.
, а з нього і середнє значення питомої теплоємності досліджуваної рідини.
15. Виходячи з заданої викладачем молярної маси досліджуваної рідини, обчисліть молярну теплоємність і порівняйте Її з законом Дюлонга-Пті або Джоуля-Коппа.
Таблиця
| т | U | I | t1 | t2 | t2- t1 | τ1 | τ2 | τ2 – τ1 |
Дайте відповіді на запитання:
1. Чи може бути питома теплоємність речовини більшою за молярну теплоємність?
2. Чому теплоємності речовин при сталому тиску завжди більші за відповідні теплоємності при сталому об'ємі?
3. Сформулюйте закони Дюлонга-Пті і Джоуля-Коппа.
 2018-01-21
2018-01-21 271
271








