Предисловие
Современная подготовка инженеров существенно зависит от качества и уровня образования в области фундаментальных наук: математики, физики и химии. Роль же и место химии среди естественнонаучных дисциплин обусловлена тем, что в области материального производства людям всегда приходится иметь дело с различными веществами. При этом следует отметить ввиду того, что интенсивное развитие электроники, фотоники, сенсорики и спинторики в последние годы потребовало новых материалов со специальными свойствами, что в свою очередь привело к новому рененансу именно неорганической химии.
Общая и неорганическая химия вообще-то сложнее органической химии, так как последняя- это по своей сути химия одного элемента, а у неорганики их около ста. Переход же химических элементов к материалам исключительно сложен и многообразен. Так, для элементов, имеющих стабильные изотопы (их 82), имеется более 7*1023 сочетаний, приводящих к получению сложных веществ. Это число увеличивается на много порядков, если учесть, что большинство современных материалов производят используя метастабильные состояния, для которых более чем на 99% они характерны. Таких метастабильных состояний может быть очень много даже для одного вещества, имеющего фиксированный состав на фоне того, что свойства у этих состояний разные.
|
|
|
В связи с малым временем, отведённым на изучение этого курса. И не ставится вопрос об охвате всех направлений современной химии. Поэтому предлагаемый курс лекций направлен в основном на подготовку специалистов, которым предстоит работать в нехимических отраслях промышленности, строительстве и транспорте, опирающихся в своей работе не только на химические законы.
Построение курса, по мнению автора, должно способствовать использованию его в самостоятельной работе студентов, в том числе и в УИРС. В этой связи основное внимание в лекциях уделяется тем понятиям и закономерностям, которые составляют “азбуку и ядро химических знаний”, а также проблемным и нерешенным вопросам в естествознании. Кроме этого в курсе рассматриваются и вопросы, отражающие характер конкретных специальностей. Частично же предлагаются и материалы, которым мало внимания уделено в учебниках по химии. Это касается таких вопросов, как вода в природе и технике, о флюидном состоянии веществ, экологических проблем и т.д.
Курс лекций по соответствующим темам и утверждён на заседании кафедры химии БелГУТа, протокол № от 2013г. И рекомендован к внедрению в учебном процессе……..
Тема 1. Общие представления. Химический мир.
Введение в химию.
1.1. Происхождение химии.
|
|
|
1.2. Научный подход
1.3. Измерение и метрическая система единиц.
1.4. Состояние вещества
1.5. Классификация веществ
1.6. Разделение смесей
1.7. Чистые вещества и соединения
1.8. Атомистическая теория и общее представление о строении атома
1.9. Общее ознакомление с таблицей химических элементов Д.И Менделеева
1.10. Молекулы и ионы
1.11. Названия неорганических соединений.
Введение в химию
Можно сразу отметить, что происхождении слова “химия” нет единой точки зрения. В самостоятельную дисциплину она начала формироваться только в 17-18 веках. Возникновение же научной химии обычно связывают с именем Роберта Бойля(1627-1691). Пожалуй он первым пытался дать определение понятия химического элемента в своей книге “Химик-скептик” (1661) и тем самым определил её центральный объект исследования. Элементы же по Бойлю составляли предел разложения вещества на составные части.
В результате трудов Р.Бойля возникла новая концепция химического элемента. Его эксперименты наметили путь к созданию первых общехимических теорий,касающихся важнейшего процесса – горения. По оценке Ф. Энгельса, сделанной им в “Диалектике природы”,- “Бойль делает из химии науку”. Эта была справедливая оценка, но полностью превращение химии в науку, как систему достоверных фактов, полученных экспериментальным путём, завершилось усилиями многих учёных, последователей Р.Бойля, разрешивших первую важнейшую тайну химии – тайну горения и дыхания.
Интересное высказывание о химии, как зарождающейся науке, имеется у М.В Ломоносова (1711-1765): “Так как внутреннее строение тел вызывает главным образом химия, то без неё труден, даже невозможен доступ к их глубинам и тем самым к раскрытию истинной причины электричества…….” И можно добавить: “а также глобального загрязнения окружающей среды, которое может стать основной причиной самоуничтожения современной цивилизации без внешних (космических) катаклизмов” Но это ещё не говорит о том, что химия, как наука, способна привести мировую экономику к безопасному существованию и устойчивому развитию. Сложившаяся ситуация в мире намного сложнее и тревожнее, что иллюстрирует в какой- то степени рис.1
Рис. 1. Путь человечества к экологической экономике – устойчивому развитию.
Сегодняшнее население Земли находится в самом критическом состоянии за всю историю своего развития, которого она никогда не испытывало. Главная суть этой проблемы состоит ещё и в том, что сохранение равновесия и контроль за численностью людей в мире потребует такой высочайшей социальной ответственности, которая человечеством ещё не достигалась. Она же и не появится до тех пор, пока не будут глубоко осознаны те ограничения, которые минеральные ресурсы накладывают на численность народонаселения, на темпы разработки ресурсов и жизненный уровень людей. И вот что интересно, об этом напоминал ещё веке англ. экономист Р. Мальтус (1766-1834), но его не поняли и даже “доказали” несостоятельность подобной концепции. Но как предотвратить надвигающуюся катастрофу?... Заслон этим бедам видится в первую очередь в повышении уровня образования, культуры и квалификации, в укреплении дисциплины во всех сферах экономики.
Важнейшая же задача по обеспечению устойчивого развития, в основе которого лежит сохранение сложившегося круговорота веществ на Земле, будет возложена в определённой степени на химию и её прикладные области знаний. Поэтому уже сегодня она должна занимать доминирующее положение среду всех наук естествознание, что и наблюдается в настоящее время в высокоразвитых государствах. До этого и понятно, так как в любой области человеческой деятельности, связанной с какими – либо проявлениями материального мира, неизбежно приходится сталкиваться с фундаментальными свойствами различных веществ – их прочностью, способностью взаимодействовать с другими веществами, а также с их изменениями в соответствующих условиях. В то же время, будучи фундаментальной наукой, тесно связанной с любым проявлением наших контактов с материальным миром, химия представляет собой ещё и неотъемлемую часть общечеловеческой культуры.
|
|
|
В последние годы мы стали осознавать, что принижение роли химии и почти полное отсутствие знаний по ней в нехимических отраслях промышленности, транспорта, энергетики и в других сферах привело к ускоренному загрязнению окружающей среды и учащению крупных катастроф с человеческими жертвами. Многие учёные даже убеждены, что из-за глобального загрязнения всей планеты судьбы нашей цивилизации якобы предрешена. Действительно ли это так, покажет будущее… Однако? Что? Сидеть и ждать?......
Нельзя не отметить и трудности, с какими встречаются студенты дневной и безотрывной формы обучения при изучении химии. Подобное часть вызвано неправильным изложением и путанными объяснениями в современных учебниках и пособиях по химии. В настоящем же курсе все темы изложены с максимальной доходчивостью, а в конце тем даются контрольные вопросы для закрепления изучаемого материала.
Мы надеемся, что, прежде чем материал по той или иной теме будет изложен на лекции, студенты ознакомятся с ним заранее самостоятельно по рекомендуемой литературе и электронному варианту лекций данного курса. Это необходимо для усвоения основных понятий и терминов до обсуждения их на лекции, что будет способствовать лучшему пониманию химии в целом, как важнейшей науки естествознания, необходимой при получении инженерного, экономического и экологического образования.
В целях более эффективного закрепления знаний по химии будет продолжена апробированная на кафедре форма допуска студента к выполнению лабораторных работ с использованием нового образца лабораторного журнала. Согласно этой формы студент должен заранее изучить теоретический материал по тебе лабораторного занятия и занести в первые две (из трёх) колонки журнала названия опытов, порядок их выполнения с записью уравнений химических реакций, касающихся существа экспериментов (по каждому опыту). Третья колонка журнала должна заполняться уже на занятии с результатами опытов, расчетами, выводами и защитой в конце занятия.
|
|
|
Студент будет допущен к выполнению лабораторной работы в том случае, если, изучив предварительно (самостоятельно) теоретический материал по работе, он заполнит две указанные выше колонки лабораторного журнала и ответит на 1-2 вопроса по существу темы занятия. Без выполнения такой предварительной подготовки студент к выполнению лабораторной работы не допускается с соответствующими последствиями (отстранение от занятий до устранения допущенных ошибок).
Не допускается к занятию студент и тогда, когда, после выполнения лабораторной работы он не успел её защитить. В этом случае студент обязан в течении недели (до следующей лабораторной работы) защитить её у преподавателя, чтобы получить допуск к последующему занятию с выполнением выше изложенных требований.
При такой форме проведения лабораторных занятий не нужны будут домашние задания, так как предлагаемый вариант при подготовке к выполнению лабораторных работ перекрывает объём времени студента, затрачиваемого на выполнение домашних заданий и высвобождает преподавателя от рутинной работы на их проверку (а это и переписывание при неудовлетворительных оценках, лишняя трата бумаги, времени и др.).Это же будет способствовать ещё и укреплению дисциплины и ответственности студентов за учёбу перед Государством, не будет больше ссылок на то, что их плохо научила средняя школа и т.п…
Так как практические занятия по химии проводятся один раз в две недели, то в этом случае можно дать индивидуальное задание каждому студенту, но только по одной комплексной задаче среднего уровня сложности, охватывающей одну-две темы или несколько законов химии…..
Такая форма обучения химии позволяет индивидуально работать с более подготовленными студентами к занятиям, что в свою очередь даст возможность объективно оценивать текущую успеваемость студентов при непомерно большой нагрузке на преподавателя….
Лет 25-30 назад перед экзаменом по химии студенты сдавали ещё по ней официальный зачёт и не в виде “автоматов”, … а направленный на проверку знаний выполнения экспериментальных работ по всему изучаемому курсу … с зачётной ведомостью… и т.п. У государства тогда было больше ответственности за качество подготовки специалистов для Народного хозяйства….
Скорее всего люди пытались понять превращение материи ещё до того, как они начали использовать их в своих целях.
Так, древнегреческие философы считали, что природа состоит из четырёх элементов –начал: огня, земли, воздуха и воды. Позже было расширено уточнение основных свойств этих элементов. К ним они отнесли холодное, горячее, сухое и влажное; при этом, по их мнению, каждый элемент обладал двумя связанными с ним свойствами, что иллюстрирует рис. 1.1.
Огонь
горячий сухой
воздух Земля
влажный Холодный
Вода
Вода
Рис 1.1. Схематическое изображение четырёх элементов в древнегреческой философии и четырёх свойств, связываемых с этими элементами.
Эти же представления о материи просуществовали более 1000 лет, оказывая влияние на мысли философов вилось до средних веков новой эры.
Зарождению же современной химии способствовали работы Р.Бойля, Антуана Лавуазье (1743-1794), М.В. Ломоносова (1701-1765), Джозефа Пристли (1733-1804). Многие учёные, например, считают, что создателем современной химии является франц. Учёный Лавуазье, так как он опирался в своей работе на тщательно контролируемые опыты и на использование количественных измерений.
Научный подход
В научной деятельности важных факторов является выполнение тщательных наблюдений. Исследователи, как правило, заняты поисками общих закономерностей, которые связывают воедино все их наблюдения. А целом же, мы пытаемся понять существующие в природе законы. Предположительное их объяснение называют гипотезой. Гипотезу же, выдержавшую многочисленные экспериментальные проверки, считают уже теорией. Однако путь к любой теории и путь к научным открытиям чаще всего хаотичен и неясен; прогресс часто протекает медленно, при этом многие, казалось бы, перспективные направления в науке оканчиваются тупиками. Но в жизни случаются и неожиданные открытия, которые сыграли и играют важную роль в развитии науки …. Но не покорении природы….
Измерения и метрическая система единиц.
Результаты любых измерений принято выражать в метрической системе единиц, представленных в таблице 1.1.
Таблица 1.1. Названия основных единиц СИ.
| Физическая величина | Наименование единицы | Обозначение | Размерность, dim |
| 1. Длина | Метр | м | L |
| 2. Масса | Килограмм | кг | M |
| 3.Время | Секунда | с | T |
| 4.Электрический ток | Ампер | А | i |
| 5.Термодинамическая температура | Кельвин | К | |
| 6.Количество вещества | Моль | моль | N |
| 7.Сила света | Кандела | кд | J |
Физические величины, входящие в международную систему СИ (не вошедшие в табл. 1.1), но определяемые через основные величины (представленные в табл. 1.1), получили название производных величин системы. Размерность же последних представляет собой произведение размерностей основных физических величин (табл. 1.1.), возведённых в соответствующие степени. В формулах размерностей производных величин символы размерностей основных физических величин- записываются в последовательности: LMTIONJ
Например: размерность плотности dimg=L-3M; размерность объёма dim V = L3; размерность энергии dim E = L2MT-2 и т.п., где dim – производное от англ. Dimension –размер, размерность.
В общем случае размерность любой физической величины Х может быть выражена равенством: dimX = LaMbTcIdOf…., где a, b, c, d, f …. – целые числа, показатели размерностей физической величины Х.
Принятие системы СИ является попыткой дальнейшей систематизации метрической системы. Пока же единицы системы СИ не полностью вошли в научную практику, наряду с единицами системы СИ приходится знать и внесистемные единицы, всё ещё применяемы в настоящее время. Ни одного государство мира не перешло ещё на систему СИ (слишком дорого).
Эти основные единицы называются единицами Международной системы, или просто единицами СИ, принятыми в 1960 г. (табл. 1.1.).
Например, при измерении температуры в разных странах пользуются температурными шкалами (рис. 2.2.) Кельвина (К), Целься (0С) и фаренгейта (0F). Последнюю шкалу применяют в США…
373К 1000С 2120F
273К 00С 320F
Рис. 1.2. Сравнение температурных шкал Фаренгейта (0F), Цельсия (0C) и Кельвина (К).
Например, температура 30 0С, нужно выразить эту температуру а) в К; б) в 0F. Решение: а)К= 273+30=303К. б) 0C= 5/9 (0F-320), 300 С =5/9(0F-32), 0F= 9/5 (300)+32=860F.
Погрешность измерений можно выразить, например, при помощи так называемых значащих цифр. При определении же значащих цифр в записях результатов измерений следует пользоваться правилами: так величина 235 см состоит из трёх значащих цифр, а 0,25 см – из двух значащих цифр; величина 0,0100 имеет три значащие цифры, а 2,0 – две; 1,03*104 – три значащие цифры, а 1,020*104 – четыре и т.д. Каково же практическое использование значащих цифр?...
Пример 1.1. В чём различие между записями результатов измерения: 3,0 г и 3,00 г? Решение. Число 3,0 имеет две значащие цифры, а число 3,00 – три значащие цифры. Это означает, что второе измерение выполнено более точно.
Результат же 3,0 г указывает на то, что масса образца должна быть заключена в интервале от 2,95 до 3,05, а это ближе к 3,0 г, чем 2,9 или 3,1г. Результат 3,00 г означает, что образец должен иметь массу от 2,995 до 3,005 г,которая ближе к 3,00, чем 2,99 или 3,01г…. (первый результат измерен до сотых долей, а второй с точностью до тысячных долей).
Для указания десятичных кратных или десятичных долей различных единиц в метрической системе используется ряд приставок к основных названиям, представленным в табл. 1.2.
Таблица 1.2. Множители и приставки для обозначения десятичных кратных и дольных единиц.
| Приставки | Множитель | |
| Наименование | Обозначение | |
| тера | Т | 1012 |
| Гига | Г | 109 |
| Мега | М | 106 |
| Кило | К | 103 |
| Гекто | Г | 102 |
| дека | да | 10 |
| Деци | Д | 10-1 |
| Санти | С | 10-2 |
| Мили | М | 10-3 |
| Микро | Мк | 10-6 |
| Нано | Н | 10-9 |
| Пико | П | 10-12 |
| фемто | ф | 10-15 |
При использовании метрической системой и при решении задач, удобно прибегать к степенной форме записи численных величин.
Состояние вещества
Вещество может существовать в трех основных агрегатных состояниях:газообразном,жидком и твердом.Газ не имеет ни собственной формы,ни фиксированного объема.Он принимает только форму и объем того сосуда,в который он помещен.Его можно сжать,поместив в меньший сосуд или расширить,перенося газ в больший сосуд по объему относительно первого.
Жидкость не имеет своей формы как и газ,она принимает форму той части сосуда,которую заполняет. Сжимаемость жидкостей в отличие от газов очень маленькая.
Твердые вещества обладают механической прочностью. Они имеют фиксированный объем и форму. Подобно жидкостям твердые тела сжимаются незначительно.
Состояния веществ зависят от температуры и давления. Например, вода в интервале температур от 0  до 100
до 100 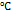 находится в жидком состоянии,при температуре
находится в жидком состоянии,при температуре  100
100  она превращается в пар, а при температуре 0
она превращается в пар, а при температуре 0  и меньше вода находится в твердом состоянии. Все эти переходы воды из одного состояния в другое являются примерами физических превращений (не сопровождаются образованием новых веществ). Химические же превращения заключаются в превращении одного вещества в другое, а химические свойства определяют способность веществ превращаться в другие.
и меньше вода находится в твердом состоянии. Все эти переходы воды из одного состояния в другое являются примерами физических превращений (не сопровождаются образованием новых веществ). Химические же превращения заключаются в превращении одного вещества в другое, а химические свойства определяют способность веществ превращаться в другие.
 2018-01-21
2018-01-21 810
810







