1. Водородно ‒ водородная (газовая) цепь:
Pt, H2 | H+ || H+ | H2, Pt
Анод: ½H2 ‒ ē → H+ H+ + ē → ½H2: Катод
Электрод Электрод
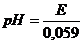 определения сравнения
определения сравнения
E = φ0H2 ‒ φH2 = ‒ φH2 = 0,059pH
2. Водородно ‒ хлорсеребряная цепь:
Pt, H2 | H+ || Cl ‒, AgCl | Ag
Электрод Электрод
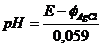 определения сравнения
определения сравнения
E = φAgCl ‒ φH2 = φAgCl + 0,059pH
3. Водородно ‒ каломельная цепь:
Pt, H2 | H+ || Сl‒, Hg2Cl2 | Hg
Электрод Электрод
 определения сравнения
определения сравнения
E = φHg2Cl2 ‒ φH2 = φHg2Cl2 + 0,059pH
4. Цепь из стеклянного и хлорсеребряного электрода:
Ag | AgCl, Cl‒ ¦ pH=x | Cl‒, AgCl | Ag
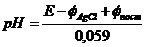 Электрод определения Электрод сравнения
Электрод определения Электрод сравнения
E = φAgCl ‒ φсэ = φAgCl ‒ φпост + 0,059pH
Лекция №18 Адсорбционные равновесия и процессы на подвижных поверхностях раздела.
Адсорбция ‒самопроизвольное перераспределение молекул компонента между объёмом фазы и поверхностью раздела.
Положительная ‒ сопровождается накоплением компонента на поверхности.
Отрицательная ‒ сопровождается накоплением компонента в глубине фазы.
Основные понятия
Адсорбенты ‒ вещества, на поверхности которых идут адсорбционные процессы. Бывают жидкие и твёрдые.
Адсорбтивы ‒ вещества, которые накапливаются на поверхности адсорбента. Находятся в жидком или газообразном состоянии.
Адсорбционная система с подвижной поверхностью раздела фаз реализуется в случае жидкого адсорбента.
Адсорбционная система с неподвижной поверхностью раздела фаз ‒ в случае твёрдого адсорбента.
Причина адсорбции ‒энергетическая неуравновешенность частиц адсорбента в поверхностном слое, что ведёт к возникновению поверхностной энергии (СЭП, Gs).
СЭП ‒термодинамическая функция, характеризующая энергию межмолекулярного взаимодействия частиц на поверхности раздела фаз с частицами каждой из контактирующих фаз.
Gs = σ · S, где S ‒ площадь поверхности адсорбента,
S ‒ главная характеристика твёрдого адсорбента.
 2018-01-21
2018-01-21 3033
3033








