Лекция. Растворы.
Растворы – это гомогенные (однофазные) системы переменного состава, состоящие из двух или более веществ (компонентов).
Классификация:
1. по агрегатному состоянию: газообразные, жидкие, твердые. Пример: воздух, раствор соли, сплавы металлов.
2. по массе растворенного вещества: вещества с молярной массой меньше 5000 г/моль называются растворами низкомолекулярных соединений (НМС), а растворы веществ с молярной массой больше 5000 г/моль – растворами ВМС.
3. по концентрации: разбавленные, концентрированные, насыщенные, пересыщенные.
(варим варенье)
4. По наличию или отсутствию электролитической диссоциации растворы НМС подразделяют на два класса – растворы электролитов (NaCl) и неэлектролитов (сахар).
5. Растворы НМС (электролитов и неэлектролитов) разделяют на истинные и коллоидные. Истинные растворы характеризуются гомогенностью состава и отсутствием поверхности раздела между растворенным веществом и растворителем. Размер растворенных частиц (ионов и молекул) меньше 10-9м (кислотный дождь и туман).
Компонент, который в данных условиях находится в том же агрегатном состоянии, что и образующийся раствор, считают растворителем, остальные составляющие раствора – растворенными веществами. В случае одинакового агрегатного состояния компонентов растворителем считают тот компонент, который преобладает в растворе.
Термодинамика образования растворов:
При растворении газов в жидкости энтропия всегда уменьшается Δ S < 0,
При растворении кристаллов возрастает (Δ S > 0).
Разрушение кристаллической решетки на свободные ионы (Δ H > 0)
Взаимодействие образовавшихся ионов с молекулами растворителя (сольтивация, Δ H < 0).
Независимо от знака энтальпии при растворении (абсолютно нерастворимых веществ нет) всегда Δ G = Δ H – T ·Δ S < 0, т. к. переход вещества в раствор сопровождается значительным возрастанием энтропии вследствие стремления системы к разупорядочиванию.
Для жидких растворов (расплавов) процесс растворения идет самопроизвольно (Δ G < 0) до установления динамического равновесия между раствором и твердой фазой.
Способы выражения концентрации растворов.
1. К безразмерным концентрациям (долям) относятся следующие концентрации:
Массовая доля растворенного вещества ω выражается в долях единицы или в процентах:
 или
или 
Объемная доля растворенного вещества σ выражается в долях единицы или объемных процентах:
 или
или 
Мольная доля растворенного вещества χ (B) выражается соотношением
 или
или  сумма
сумма 
К размерным концентрациям относятся следующие концентрации:
Моляльность растворенного вещества Cm (B) определяется количеством вещества n (B) в 1 кг (1000 г) растворителя, размерность моль/кг.
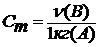
Молярная концентрация вещества B в растворе C (B) – содержание количества растворенного вещества B в единице объема раствора, моль/м3, или чаще моль/литр:

Молярная концентрация эквивалентов вещества B C Н (B) (нормальность) определяется числом эквивалентов растворенного вещества в единице объема раствора, моль∙литр–1:

Рассказать о связи молярности и нормальности
Титр раствора вещества B (T B) определяется массой растворенного вещества в г, содержащегося в 1 мл раствора: 
Массовые концентрации (массовая доля, процентная, моляльная) не зависят от температуры; объемные концентрации относятся к определенной температуре.
Все вещества в той или иной степени способны растворяться и характеризуются растворимостью. Некоторые вещества неограниченно растворимы друг в друге (вода–ацетон, бензол–толуол, жидкие натрий–калий). Большинство соединений ограниченно растворимы (вода–бензол, вода–бутиловый спирт, вода–поваренная соль), а многие малорастворимы или практически нерастворимы (вода–BaSO4, вода–бензин).
Растворимостью вещества при данных условиях называют его концентрацию в насыщенном растворе. В таком растворе достигается равновесие между растворяемым веществом и раствором. В отсутствие равновесия раствор остается стабильным, если концентрация растворенного вещества меньше его растворимости (ненасыщенный раствор), или нестабильным, если в растворе содержится вещества больше его растворимости (пересыщенный раствор).
Растворы неэлектролитов
По термодинамическому признаку растворы делятся на идеальные и реальные. Для идеальных растворов предполагается, что между компонентами раствора любыми взаимодействиями можно пренебречь. Следовательно, любое свойство растворяемых веществ при их смешении не должно меняться. Например, при смешении близких по свойствам бензола и толуола давление пара P над раствором в соответствии с законом Рауля будет аддитивной величиной
Р = Р Б + Р Т = Р Б0χБ + Р Т0χТ
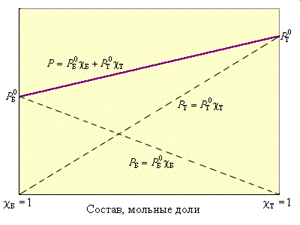 Если раствор сохраняет свойства идеальности при любых концентрациях, его называют идеальным (растворы изотопов). Часто раствор приобретает эти качества только при достаточно большом разведении, это – «бесконечно разбавленный» раствор при χ → 0. Во всех прочих случаях раствор считается реальным.
Если раствор сохраняет свойства идеальности при любых концентрациях, его называют идеальным (растворы изотопов). Часто раствор приобретает эти качества только при достаточно большом разведении, это – «бесконечно разбавленный» раствор при χ → 0. Во всех прочих случаях раствор считается реальным.
Взаимодействие между компонентами раствора, выражаемое через энтальпию сольвации ΔHсольв, служит в определенных пределах мерой идеальности раствора. Энтальпия сольватации – тепловой эффект внедрения молекулы растворенного вещества в растворитель.
1-ый закон Рауля. Парциальное давление пара летучего компонента над раствором прямо пропорционально его мольной доле в растворе
Пусть Р В << Р А, т.е. вещество В является нелетучим компонентом. Тогда Р А = Р А0χА
χА = 1 – χВ, следовательно:
Р А = Р А0χА = Р А0(1 – χВ) = Р А0 – Р А0 χВ, следовательно 
2-ой закон Рауля – понижение температуры кипения (эбулиоскопия это метод) и повышение температуры замерзания (криоскопия это метод) раствора прямо пропорционально моляльной концентрации раствора:
∆Т = k Cm
Закон Генри
Упругость пара – это его парциальное давление. Если растворенное вещество характеризуется большой упругостью пара по сравнению с упругостью пара растворителя (P А >> P р-рителя) и при этом оба компонента раствора химически инертны, то растворение такого газообразного вещества в жидкости подчиняется закону Генри: при постоянной температуре давление летучего (газообразного) компонента P А прямо пропорционально его мольной доле χА в растворе: т.е. каждый компонент растворяется в растворителе независимо друг от друга.
Р А = К Г0χА, где KГ – константа Генри. Константа Генри зависит от природы газа, рас–творителя и температуры. В табл. приведены константы Генри некоторых газов для воды.
| Газ | H2 | He | Ar | N2 | O2 | CO2 |
| KH | 29,3 |
Растворимость газов в жидкостях зависит от температуры и давления:
- чем больше температура, тем ниже растворимость;
- чем больше давление, тем больше растворимость.
Изучая растворимость газов в жидкостях в присутствии электролитов, русский врач физиолог И. М. Сеченов (1829—1905) установил следующую закономерность (закон Сеченова): растворимость газов в жидкостях в присутствии электролитов понижается; происходит высаливание газов.
Пиво – раствор, пересыщенный по углекислому газу. СО2 плохо растворяется в NaCl и кислотах: Н2СО3 ↔ СО2 +Н2О равновесие по принципу Ле-Шателье сдвигается вправо.
Осмос.
Если система, разделенная мембраной, представляет собой растворы, в которых через мембрану способны проходить только молекулы растворителя, то свойства ее будут определяться разностью мольных долей (концентраций) растворителя по обе стороны мембраны.
Явление, связанное со способностью проходить через мембрану только одного типа молекул, содержащихся в системе, называется осмосом, а вызываемое им изменение давления по обе стороны мембраны – осмотическим давлением. Явление осмоса определяется природой мембраны и компонентов раствора.
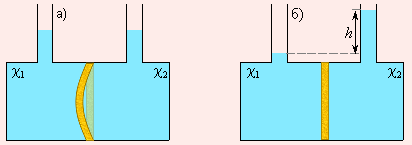 Представим, что сосуд с двумя горлами для залива раствора разделен мембраной M (рис. 6.4). В каждую часть сосуда зальем растворы, отличающиеся только концентрацией. Поскольку мольные доли растворителя по обе стороны мембраны не совпадают, то стремление их к выравниванию приведет к переходу части растворителя в ту часть сосуда, где концентрация растворенного вещества больше. Увеличение количества растворителя эквивалентно возрастанию давления, и если мембрана способна к деформации, она изогнется в сторону с меньшей концентрацией растворенного вещества (рис. 6.4а).
Представим, что сосуд с двумя горлами для залива раствора разделен мембраной M (рис. 6.4). В каждую часть сосуда зальем растворы, отличающиеся только концентрацией. Поскольку мольные доли растворителя по обе стороны мембраны не совпадают, то стремление их к выравниванию приведет к переходу части растворителя в ту часть сосуда, где концентрация растворенного вещества больше. Увеличение количества растворителя эквивалентно возрастанию давления, и если мембрана способна к деформации, она изогнется в сторону с меньшей концентрацией растворенного вещества (рис. 6.4а).
Если мембрана жесткая, то в отсеке с большей концентрацией количество растворителя будет возрастать до тех пор, пока гидростатическое давление h (рис. 6.4б) не станет равным осмотическому давлению и не прекратит осмос.
Осмотическое давление π – внутреннее давление растворенного вещества, численно равное тому внешнему давлению, которое нужно приложить, чтобы прекратить осмос; оно зависит от температуры и концентрации.
Эту зависимость Вант-Гофф уподобил поведению идеального газа: 
По Вант-Гоффу осмотическое давление раствора численно равно тому газовому давлению, которое имело бы растворенное вещество, будучи переведенным в газообразное состояние в том же объеме и при той же температуре. Поскольку объем (разбавление) обратно пропорционален концентрации, то закон Вант-Гоффа можно записать в виде 
Так как объем одного моля газообразного вещества при нормальных условиях равен 22,4 литра, то осмотическое давление раствора, содержащего 1 моль вещества, равно 22,4 атм.
Измерение осмотического давления раствора используется для определения молекулярных масс растворимых высокомолекулярных соединений, в частности, биополимеров.
Заменив концентрацию на соотношение 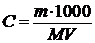 , получим уравнение, позволяющее вычислять молекулярные массы растворенных веществ:
, получим уравнение, позволяющее вычислять молекулярные массы растворенных веществ:

m (B) – масса растворенного вещества, V – объем раствора.
Если растворы характеризуются одинаковыми осмотическими давлениями, то по Вант-Гоффу такие растворы называются изотоническими. Независимо от природы растворенного вещества, изотоничность является следствием одинакового числа частиц в растворе.
Изотонические физиологические растворы — водные растворы, изотоничные плазме крови. Простейшим раствором такого типа является 0,9%-й водный раствор хлорида натрия (NaCl).
Ионы натрия и хлора являются важнейшими неорганическими компонентами внеклеточной жидкости, поддерживающими соответствующее осмотическое давление плазмы крови и внеклеточной жидкости.
Раствор натрия хлорида 0,9% оказывает плазмозамещающее, дезинтоксикационное, гидратирующее действие, способствует нормализации кислотно-щелочного состояния, восполняет недостаток ионов натрия.
Поскольку при растворении реальное число частиц может отличаться от числа растворенных молекул, Вант-Гофф ввел понятие изотонического коэффициента i. По определению это отношение числа всех частиц к числу растворенных молекул:

По мере увеличения разведения коэффициент Вант-Гоффа приближается к простому целому числу (2,3,4 – в зависимости от числа ионов, образующихся при растворении молекул вещества):
NaCl = Na+ + Cl− i→2
K2SO4 = 2K+ + SO  i→3
i→3
AlCl3 = Al3+ + 3Cl− i→4
K4[Fe(CN)6] = 4K+ + [Fe(CN)6]2− i→5
Если в растворе преобладают процессы образования ионов, то i > 1
Если ассоциации, то i < 1
Например, в бензольном растворе уксусной кислоты происходит образование димеров последней:

Так, в водном растворе уксусная кислота диссоциирует CH3COOH = CH3COO– + H+, и число частиц становится больше числа молекул.
http://chemistry.ru/course/content/chapter6/section/paragraph4/theory.html#.WCcQ0NSLTGg
 2018-01-21
2018-01-21 776
776






