ХІМІЧНІ ВЛАСТИВОСТІ ФУЛЕРЕНІВ
Фулерен є ароматичним з точки зору електронної будови та спектральних властивостей, однак, з точки зору хімічних властивостей, фулерен веде себе як полієн.
Основні типи реакцій, у які вступають фулерени:
1. Приєднання водню та галогенів.
2. Електрохімічне відновлення.
3. Відновлення металами.
4. Приєднання вільних радикалів.
5. Утворення іон-радикальних солей.
6. Окиснення.
7. Реакції з кислотами Льюіса.
7. Реакції з діазосполуками.
Реакції відновлення
Історично першим вивченим з хімічних властивостей фулерену було його відновлення. Як тільки стала зрозумілою електрофільна природа фулерену, були здійснені різні реакції, наприклад з активними металами, активними органічними молекулами - донорами електронів, електрохімічне відновлення, для отримання фуллеренових солей. Аніон фулерену виявився достатньо активним учасником багатьох реакційу електрофільнихатакх, що відкрило синтетичні підходи до органічної хімії фулерену.
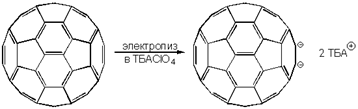
Електрохімічне відновлення фулерену-60 може бути здійснено в перхлораті тетра-н-бутіламмонія (ТБАClO4)та утворюється за наведеною схемою темно-червоноийдіаніон:
Обробка отриманого розчину йодистим метилом призводить до утворення темно-коричневого розчину діметілдігідрофуллерена C60 (CH3)2 (суміш продуктів 1,2 - і 1,4-приєднання):
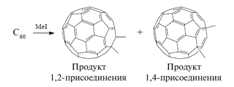
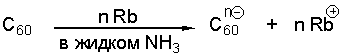 |
Дуже легко відбуваються реакції хімічного відновлення фулеренів активними електропозитивними металами, наприклад, розчином рубідію в рідкому аміаку. Вихідний фулерен беруть у вигляді суспензії, а поліаніон виявляється розчинним в аміаку:
В якості відновників стосовно фуллерену можуть виступати і органічні речовини, що є досить активними донорами електронів. Перші такі комплекси були синтезовані простим змішуванням реагентів у відповідному неполярному розчиннику, наприклад, в бензолі. Утворені при цьому комплекси досить добре розчинними у таких полярних розчинниках, як бензонітрил або тетрагидрофуран, що виключно полегшує їх виділення. У певних умовах утворення комплексів виявляється оборотним; так, наприклад, комплекс з тетра-(N, N-диметиламіно) етиленом в толуолі:
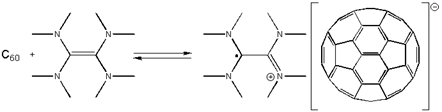
Утворений комплекс володіє унікальними для органічних молекул, магнітними властивостями.
ГІДРУВАННЯ
Оскільки молекула фулерену виявляє спорідненість до електрона, у хімічних процесам поводить себе як слабкий окисник. При гідрогенізації фулерену продукт з найбільшою к-стю приєднаних атомів Гідрогену виявився С60Н36, а не C60H60.Цепояснюється тим, що утворення такого похідного супроводжується значною сферичною деформацією молекули, де частина атомів водню повинна опинитися всередині фуллереновой сфери, так як шестичленні кільця, подібно молекулам циклогексану, повинні прийняти конформації "крісла" або "ванни"; саме неможливість збереження сфери, нехай навіть перекрученою, обумовлює неуспіх повного гідрування і ту виняткову легкість, з якою утворилися гідриди втрачають водень.
Для отримання ди- і тетрагідридов найбільш ефективними є методи гідроборирования (взаємодія з ВН3) та гідроцирконування (відновлення дициклопентадиенилцирконийгидрохлоридом, мають сендвіч-структуру):
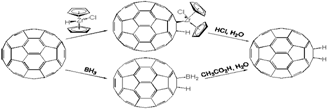
Пряме гідрування фулерену не застосовується, оскільки вимагає жорстких умов. Цікавість до реакції гідрування обумовлена тим, що фулерен можна використовувати як ефективне вмістилище для молекулярного водню.
ГАЛОГЕНУВАННЯ
Цікавість до реакції фторування обумовлена тим, що на основі фторвміснихфулеренів можна створювати мастильні матеріали подібні тефлону, які будуть залишатися стабільними при досить низьких температурах.
Пряме фторування фулерену можливе, але дає низькі виходи продуктів, тому використовують фториди перехідних металів, що дало можливість шляхом варіювання умов синтезу, отримувати певні похідні фулерену із заданою кількістю фторів.
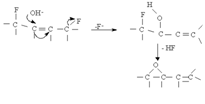
У розчинах фториди легко окислюються, а також утворюють гідроксофторидифулеренів під дією слідів води, що ускладнює роботу з ними. Деградація фторидів здійснюється за механізмом нуклеофільного заміщення, наприклад:
Або: C60F36 + H2O = C60F34O + 2 HF
Для фулеренів відносно легко проходять реакції хлорування і бромування; так, наприклад, утворюються хлорид C60Cl12(24), броміди C60Br8, C60Br24, причому остання молекула є високосимметричною. Всі вони виключно легко втрачають галоген при нагріванні вже до 150 ° С.
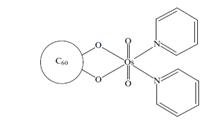
Утворення комплексів з перехідними металами
Фулерен вступає у реакції комплексоутворення з перехідними металами (метали платинової групи). Як показали дослідження, при приєднанні до фулерену металовмісного органічного радикалу, зменшує спорідненість молекули до електрону. Це змінює електричні властивості фулеренів та дає можливість створити новий клас органічних напівпровідників.
ПОЛІМЕРИЗАЦІЯ
Молекули фулерену можуть грати двояку роль у таких процесах: в якості основи полімерно ланцюга та у якості з’єднувального матеріалу. Другий варіант поки не вдалось реалізувати на практиці. Найбільшу цікавість привернула ідея створення плівки, яка повністю скаладалась би лише з молекул фулерену. У таких плівках молекули фулерену зв’язані між собою хімічними зв’язками, на відміну від фулериту, де взаємодія представлена слабкими Ван-дер-Ваалсьсовськими зв’язками. Це так звана фотополімеризація, де при опроміненні спочатку утворюються димерами, а далі - інші олігомери, включаючи (C60)20. «Міжфулеренові" С-С зв'язки мають виняткову довжину - більше 2-х А, а сфери дещо витягнутими по відношенню один до одного.
 2018-01-21
2018-01-21 469
469







