Первый закон термодинамики.
В задачах (370-394) определите стандартный тепловой эффект реакции при:
а) изобарном её проведении - D r H 0298;
б) изохорном её проведении - D r U 0298
(стандартные значения термодинамических функций приведены в приложении)
| № п/п | Уравнение реакции |
| 4HCl (г) +O2 (г) = 2H2O (г) + 2Cl2 (г) | |
| CH4 (г) + 2O2 (г) = CO2 (г) + 2H2O (ж) | |
| Fe3O4 (к) + 4CO (г) = 3Fe (к) + 4CO2 (г) | |
| 3Fe3O4 (к) + 8Al (к) = 4Al2O3 (к) + 9Fe (к) | |
| 3H2O (г) + 2Al (к) = Al2O3 (к) + 3H2 (г) | |
| Fe3O4 (к) + 4H2 (г) = 3Fe (к) + 4H2O (г) | |
| S (к)+ 2N2O (г) = SO2 (г) + 2N2 (г) | |
| H2S (г) + Cl2 (г) = 2HCl (г) + S (к) | |
| CO (г) + H2O (г) = CO2 (г) + H2 (г) | |
| Fe2O3 (к) + 3CO (г) = 2Fe (к) + 3CO2 (г) | |
| 2PbS (к) + 3O2 (г) = 2PbO (к) + 2SO2 (г) | |
| CaCO3 (к) = CaO (к) + CO2 (г) | |
| Fe (к) + H2O (г) = FeO (к) + H2 (г) | |
| 2CO2 (г) = 2CO (г) + O2 (г) | |
| Fe2O3 (к) + CO (г) = 2FeO (к) + CO2 (г) | |
| PbO (к) + CO (г) = Pb (к) + CO2 (г) | |
| C2H4 (г) + H2O (г) = C2H6O (г) | |
| FeO (к) + Mn (к) = MnO (к) + Fe (к) | |
| 2FeO (к) + Si (к) = 2Fe (к) + SiO2 (к) | |
| FeO (к) + C (к) = Fe(к) + CO (г) | |
| 3Fe2O3 (к) + H2 (г) = 2Fe3O4 (к) + H2O (г) | |
| GeO2 (к) + 2Cl2 (г) + 2C (к) = GeCl4 (г) + 2CO (г) | |
| CH4 (г) + H2O (г) = CO (г) + 3H2 (г) | |
| WO3 (г) + 3H2 (г) = W (к) + 3H2O (г) | |
| 2MoO2 (к) + 6CO (г) = Mo2C (к) + 5CO2 (г) |
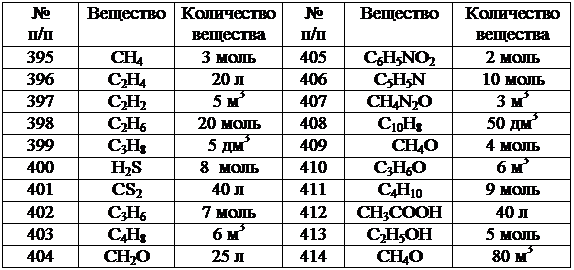
В задачах (395-414) вычислите, сколько теплоты выделится при полном сгорании указанного количества вещества при стандартных условиях. Учтите, что в продуктах сгорания углерод находится в виде углекислого газа, водород – водяного пара, сера – сернистого газа, азот выделяется в свободном состоянии.
В задачах (415-427) по заданным термохимическим уравнениям рассчитайте стандартную энтальпию реакции образования указанного вещества из простых веществ.
| № п/п | Термохимические уравнения реакций D r H o, кДж | Вещество |
| (I) 4As(т) + 3O2(г) = 2As2O3( D r H oI = -1328 (II) As2O3(т) + O2(г) = As2O5(т); D r H oII = -261 | As2O5 | |
| (I) 2As(т) + 3F2(г) = 2AsF3(г); D r H oI = -1842 (II) AsF5(г) = AsF3(г) + F2(г); D r H oII = +317 | AsF5 | |
| (I) 2С (т) + O2(г) = 2СO2(г); D r H oI = -220 (II) СO(г) + F2(г) = COF2(г); D r H oII = -525 | COF2 | |
| (I) 2Сr(т) + 3F2(г) = 2СrF3(т); D r H oI = -2224 (II) 2СrF3(т) + Cr(т) = 2CrF2(т); D r H oII = -38 | CrF2 | |
| (I) 2P(т) + 3Cl2(г) = 2PCl3(г); D r H oI = -574 (II) PCl5(г) = PCl3(г) + Cl2(г); D r H oII = +88 | PCl5 | |
| (I) 2Pb(т) + O2(г) = 2PbO(т); D r H oI = - 438 (II) 2PbO2(т) = 2PbO(т) + O2(г); D r H oII = +116 | PbO2 | |
| (I) Zr(т) + ZrCl4(г) = 2ZrCl2(г); D r H oI = +215 (II) Zr (т) +2Cl2(г) = ZrCl4(г); D r H oII = + 867 | ZrCl2 | |
| (I) 2ClF5(г) = Cl2F6(г) + 2F2(г); D r H oI = +152 (II) Сl2(г) + 5F2(г) = 2ClF5(г); D r H oII = - 478 | Cl2F6 | |
| (I) Ce(т) + O2(г) = CeO(т); D r H oI = - 1090 (II) 3CeO2(т) + Ce(т) = 2Ce2O3(т); D r H oII = - 332 | Ce2O3 | |
| (I) CuCl2(т) + Cu(т) = 2CuCl(т); D r H oI = - 56 (II) Cu(т) + Cl2(т) = СuCl2(т); D r H oII = - 216 | CuCl | |
| (I) HgBr2(т) + Hg(ж) = Hg2Br2(т); D r H oI = - 38 (II) HgBr2(т) = Hg(ж) + Br2(ж); D r H oII = + 169 | Hg2Br2 | |
| (I) Ir(т) + 2S(г) = IrS2(т); D r H oI = - 144 (II) 2IrS2(т) = Ir2S3(т) + S(т); D r H oII = + 43 | Ir2S3 | |
| (I) 2Fe(т) + O2(г) = 2FeO(т); D r H oI = - 532 (II) 4FeO(т) + O2(г) = 2Fe2O3(т); D r H oII = -584 | Fe2O3 |
 2018-01-21
2018-01-21 644
644








