Раздел «Строение вещества (атом, молекула, кристалл)
Пример 1.
Используя метод молекулярных орбиталей, объясните различные значения энергии и длины связи в частицах F2 и F2+
| Частица | Е св, кДж/моль | d св×109, м |
| F2 | ||
| F2+ |
Решение
Процесс образования частицы F2 можно представить записью:
F [1s22s22p5] + F [1s22s22p5] →
F2 [σ(1s)2 σ*(1s)2 σ(2s)2 σ*(2s)2 σ(2px)2π(2py)2π(2pz)2 π *(2py)2 π *(2pz)2].
Перекрывание 1s- атомных орбиталей приводит к заполнению σ(1s) - связывающей и σ*(1s)- разрыхляющей молекулярных орбиталей двумя электронами с антипараллельными спинами и не изменяет энергию связывающихся атомов и в дальнейшем может не учитываться. В молекуле F2 имеется избыток двух связывающих электронов, что соответствует одинарной связи или порядку связи n, равному единице, который для двухатомной частицы рассчитывается по формуле: 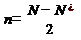 =
=  =1, где N – количество связывающих электронов, N* - количество разрыхляющих электронов.
=1, где N – количество связывающих электронов, N* - количество разрыхляющих электронов.
Все электроны в молекуле F2 спарены (спины электронов на отдельных молекулярных орбиталях параллельны) и частица не обладает магнитными свойствами (диамагнитна).
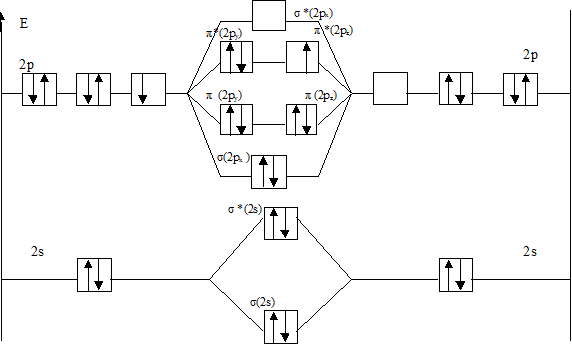
На рис.1 представлена энергетическая диаграмма образования молекулы F2.
Процесс образования частицы F2+ можно представить записью:
F [К2s22p5] + F+ [К2s22p4] →
F2+ [ККσ(2s)2 σ*(2s)2 σ(2px)2π(2py)2π(2pz)2 π *(2py)2 π *(2pz)1].
В молекулярном ионе F2+ имеется избыток трех связывающих электронов, что соответствует полуторной связи или порядку связи, равному 1,5.
Увеличение количества связывающих электронов приводит к упрочнению связи и уменьшению межъядерного расстояния (длины связи). В молекулярном ионе F2+ имеется один неспаренный электрон и частица обладает магнитными свойствами (парамагнитна).
На рис.2 представлена энергетическая диаграмма образования молекулы F2+.
Рис.1 Энергетическая диаграмма молекулы F2
Атомные орбитали Молекулярные орбитали Атомные орбитали

 |  | ||
Рис.2 Энергетическая диаграмма молекулярного иона F2+
Атомные орбитали Молекулярные орбитали Атомные орбитали
Пример 2.
Известно, что молекулярный ион [BrF4]+ имеет форму искаженного тетраэдра. Объясните, используя метод валентных связей, как образуется эта частица, полярна ли она?
Решение. Электронное строение атомов:
Br 1s22s22p63s23p63d104s24p5,
Br+ 4s24p4;
2p ¯¯_
F 1s22s22p5 или 2s ¯
Схема образования гибридных орбиталей брома:
4d __ __ __ __ __ 4d _ __ __ __ __
4p ¯ _ Þ 4p ___ Þ ¯____
Br+ 4s ¯ (Br+)* 4s ¯
промотирование гибридизация sp3d
(5 орбиталей)
(тригональная бипирамида)
При образовании четырех равноценных связей Br+ с атомами F по обменному механизму неподеленная электронная пара Br+ оказывается несвязывающей, что приводит к искажению пространственного расположения атомов и частица [BrF4]+ приобретает форму искаженного тетраэдра, в котором каждая связь полярна и векторная сумма электрических моментов связей (дипольных моментов) не равна нулю, т.е. частица [BrF4]+ является полярной (рис.3).
Рис.3. Схема образования связей в частице [BrF4]+
 F
F


 F Неподеленная пара
F Неподеленная пара
 Br электронов
Br электронов
 F
F
F
Пример 3.
Определите, к какому структурному типу кристаллической решетки кубической системы (тип СsС1, NaCl или ZnS) относится оксид бария BaO, если известны радиусы ионов и плотность вещества: R кат =1,36·10-10м, R анион =1,40·10-10м,
ρ = 6,022 г/см3, укажите координационное число ионов.
Решение. Перечисленные структурные типы отличаются числом формульных единиц в элементарной кубической ячейке (соответственно 1, 4, 4) и соотношением параметра элементарной ячейки (ребра куба) а и межионного расстояния (кратчайшего расстояния) d.
По исходным данным можно определить межионное расстояние d и затем рассчитать параметр элементарной ячейки а для всех трех вариантов. По вычисленному параметру элементарной ячейки рассчитываем плотность вещества и сравниваем с приведенным в условии задачи значением. Определяем структурный тип по совпадению рассчитанного и заданного значения плотности.
Определим межионное расстояние d = R кат + R анион =1,36 + 1,40 = 2,76·10-10м.
Рассчитаем параметр элементарной ячейки а:
для структурного типа CsCl (объемноцентрированный куб) -
а = 2 d /Ö3 = 2·2,76/1,732 = 3,187·10-10м;
для структурного типа NaCl (примитивный куб) -
а = 2 d = 2·2,76 = 5,52·10-10м;
для структурного типа ZnS (алмазоподобная решетка) -
а =4 d /Ö3= 4·2,76/1,732 = 6,374·10-10м.
Рассчитываем плотность вещества по формуле r = m/V = (ZM)/(NA a3), где Z – число формульных единиц, M – молярная масса вещества, N A – число Авогадро, a 3 – объем кубической элементарной ячейки:
для структурного типа CsCl -
r = 1·0,15334кг/моль / [6,02·1023моль-1· (3,187·10-10м)3] = 7864 кг/м3=7,864 г/см3;
для структурного типа NaCl -
r = 4·0,15334кг/моль / [6,02·1023моль-1· (5,52·10-10м)3] = 6053 кг/м3 = 6,053 г/см3;
для структурного типа ZnS -
r = 4·0,15334кг/моль / [6,02·1023моль-1· (6,374·10-10м)3] =2369 кг/м3 =2,369 г/см3.
Рассчитанное значение плотности совпадает с заданным только в случае структурного типа NaCl, для которого координационные числа катиона и аниона равны 6.
 2018-01-21
2018-01-21 1991
1991







