Химическая термодинамика – изучает переход химической энергии в другие формы (тепловую, электрическую) и устанавливают количественные законы этих переходов.Помимо этого хим. термодинамика определяет направленность и пределы самопроизвольного протекания реакции при заданных условиях. Объектом изучения химической термодинамики – является система. Система – это совокупность находящихся веществ в мысленном или фактически обособленной от других среды. Одна и та же система может находитсяв различных состояниях. У системы есть параметры (t, p, c (концентрация)).в химической термодинамики свойства системы рассматриваются в ее равновесном состоянии, конечным и начальным. И определяет возможность или не возможность самопроизвольного протекания процесса при заданных условиях и указанном направлении. В зависимости от условии перехода системы из одного состояния в другое, в термодинамики различают: изотермический, изобарный, изохорный и адиабатический процессы. Внутренняя энергия - включает энергию колебательную, вращательную, а также потенциальную энергию объектов силой притяжения, действующие между молекулами, атомами и внутренними частицами. Теплота – это мера энергии передаваемой от одного тела другому за счет разницы температуры этих тел, при этом перенос вещества не осуществляется. Работа - это мера энергии, переданная от одного тела другому за счет перемещения масс под действием каких либо сил. Первый закон термодинамики – теплота подведенная к системе, расходуемая на увеличение ее внутренней энергии и на совершение системной работы над внешней средой. Q= 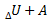 .
.
|
|
|
Уравнение в котором указывается тепловой эффект реакции называется термохимическим уравнением. Так же указывается базовое состояние исходных продуктов и продуктов реакции. В основе термохимического расчета лежит закон сохранения Гесса. Тепловой эффект зависит от вида (природы) и состоянии исходных веществ, а также конечных продуктов, но не зависят от пути процессов, т.е от числа и характера промежуточных стадий. Этот процесс протекает в 2 стадии: 1) образование оксида углерода, 2) сгорание CO.
Тепловые эффекты химических реакций. Методы расчета теплот образования и тепловых эффектов реакции. Теплотворная способность топлива.
 2018-01-21
2018-01-21 531
531








