Атом состоит из положительно заряженного ядра, в котором сосредоточена преобладающая часть массы атома, и вращающихся вокруг него электронов. Положительный заряд ядра нейтрализуется суммарным отрицательным зарядом электронов, так что атом в целом электронейтрален. Возникающая вследствие вращения электронов центробежная сила уравновешивается силой электростатического притяжения электронов к противоположно заряженному ядру.
Чем больше заряд атомного ядра, тем сильнее будет отталкиваться от него a-частица, тем чаще будут встречаться случаи сильных отклонений а-частиц, проходящих через слой металла, от первоначального направления движения. Поэтому опыты по рассеиванию a-частиц дают возможность не только обнаружить существование атомного ядра, но и определить его заряд. Уже из опытов Резерфорда следовало, что заряд ядра (выраженный в единицах заряда электрона) численно равен порядковому номеру элементав периодической системе.
Квантовые числа.
Квантовые числа — энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится.
В 1900 г. Планк показал, что способность нагретого тела к лучеиспусканию обусловлено тем, что лучистая энергия испускается или поглощается не непрерывно, а дискретно, т.е. отдельными порциями – квантами.
E=hλ
В 1905 г. Эйнштейн пришел к выводу, что электромагнитная энергия существует в форме квантов и излучение представляет собой поток неделимых частиц (фотонов), энергия которых определяется по уравнению Планка.
1. Главное квaнтовое число n определяет общую энергию электрона и степень его удаления от ядра (номер энергетического уровня); оно принимает любые целочисленные значения, начиная с 1 (n = 1, 2, 3,...)
2. Орбитальное (побочное или азимутальное) квантовое число l определяет форму атомной орбитали. Оно может принимать целочисленные значения от 0 до n -1 (l = 0, 1, 2, 3,..., n -1). Каждому значению l соответствует орбиталь особой формы. Орбитали с l = 0 называются s -орбиталями,
l = 1 – р -орбиталями (3 типа, отличающихся магнитным квантовым числом m),
l = 2 – d -орбиталями (5 типов),
l = 3 – f -орбиталями (7 типов).
3. Магнитное квантовое число m определяет ориентацию орбитали в пространстве относительно внешнего магнитного или электрического поля. Его значения изменяются от + l до - l, включая 0. Например, при l = 1 число m принимает 3 значения: +1, 0, -1, поэтому существуют 3 типа р -АО: р x, р y, р z.
4. Спиновое квантовое число s может принимать лишь два возможных значения +1/2 и -1/2. Они соответствуют двум возможным и противоположным друг другу направлениям собственного магнитного момента электрона, называемого спином (от англ. веретено). Для обозначения электронов с различными спинами используются символы: 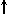 и
и  .
.
Принцип Паули.
Сформулированы в 1925 г.
1. В атоме не может быть двух электронов с одинаковыми значениями всех квантовых чисел.
2. Два любых электрона в атоме должны отличаться друг от друга, по крайней мере, одним значением квантового числа.
Принцип Паули имеет два следствия:
1. определение максимально числа электронов на энергетическом уровне
Xn=2n2
2. определение максимально числа электронов на энергетическом подуровне
Xl=2(2l+1)
Распределение электронов в атоме по энергетическим уровням и подуровням изображается в виде электронной формулы:
1s22s22p63s33p63d104s24p64d104f14
Правило Хунда.
| Главное квантовое число | ||||||||||
| Орбитальное квантовое число | ||||||||||
| Буквенное обозначение. | S | S | P | S | P | d | S | P | d | f |
Устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атома максимально.
 2018-01-21
2018-01-21 1924
1924








