Оксид железа (III)
Получение в лаборатории: 4Fe(NO3) 3 = 2Fe2O3 + 12NO2↑ + 3O2↑
У оксида Fe(III) преобладают основные свойства. Он растворяется в кислотах, образуя соли Fe(III): Fe2O3 + 6HCl = 2FeCl3 + 3H2O
Гидроксид Fe(III) обладает амфотерными свойствами с преобладанием основных. Поэтому он легко растворяется в кислотах:
2Fe(OH)3 + 3H2SO4 = Fe2(SO4)3 + 6H2O и не растворяется в щелочах. Подтверждением наличия у Fe(OH)3 кислотных свойств является существование гидроксокомплексов, простейшими из которых являются [Fe(OH)4]- и [Fe(OH)6]3-. Их можно получить, добавляя по каплям раствор соли Fe(III) в избыток концентрированной щёлочи: Fe3+ + 4OH- → [Fe(OH)4]-
[Fe(H2O)6]3+ + HOH ↔ [Fe(H2O)5OH]2+ + H3O+
В присутствии сильных восстановителей железо (III) проявляетокислительные свойства, например:
FeCl3 + 2KI = FeCl2 + KCl + I2, 2FeCl3 + H2S = 2FeCl2 + S + 2HCl.
Качественные реакции: FeCl3 + 3 КCNS = Fe(CNS)3 + 3 KCl
FeCl3 + 3 NaOH = Fe(OH)3 ↓+ 3 NaCl
3 К4[Fe(CN)6 ] +4 FeCl3 = KFe[Fe(CN)6])↓ + 12 Kcl
Fe+2NaOH+2H2O=NA2[FE(OH)4]+H2
Соединения железа (VI). Степень окисления +6 железо проявляет в ферратах, например, K2FeO4.
Одним из способов получения ферратов (VI) является окисление соединений Fe(II) или Fe(III) хлором или бромом. Для стабилизации высокой степени окисления железа нужна щелочная среда:
2FeCl3 + 16KOH + 3Cl2 = 12KCl + 2K2FeO4 + 8H2
8. Диоксид азота: его получение, взаимодействие с водой и раствором щёлочи. Азотистая кислота, нитриты, их окислительно-восстановительные свойства. Нитрит-ион как лиганд.
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O
2Pb(NO3)2= 2PbO +4NO2 +O2
2NO2+H2O=HNO2+HNO3
2KOH(разб) + 2NO2= KNO2 + KNO3 + H2O
2KMnO4+3H2SO4+5KNO2=2MnSO4+K2SO4+5KNO3+3H2O
2KNO2+2FeSO4+2H2SO4=2NO+Fe2(SO4)3+2H2O+K2SO4
| Нитрит-ион NO2- имеет угловую форму. Проявляет восстановительные свойства 5КNO2+ 2KMnO4 + 3H2SO4 ↔ 2MnSO4 + 5KNO3 + K2SO4 + 3H2O Проявляет окислительные свойства 2КNO2+ 2KI + 2H2SO4 ↔ 2NO + I2 + 2K2SO4 + 2H2O Нитрит – ион как лиганд может координироваться через атом азота, образуя нитро-комплексы, или через атом кислорода, образуя нитрито-комплексы. Такая изомерия известна для комплексов многих переходных металлов (Co3+, Rh3+, Ir3+, Pt4+). В реакциях образования комплексов Co3+ с нитрит-ионами вначале получаются нитрито-комплексы, имеющие розовую окраску которые со временем переходят в устойчивые желто-коричневые нитро-комплексы. Следует отметить, что являясь лигандом сильного поля, нитрит-ион стабилизирует в комплексах высокие степени окисления 3d-металлов. Например, Co3+ в Nа3[Со(NО2)6]. |
9. Гетерогенные равновесия в растворах малорастворимых солей, произведение растворимости. Факторы, влияющие на растворимость малорастворимых солей.
а)Гетерогенная (неоднородная) система – это система, состоящая из нескольких гомогенных фаз, разделенных между собой поверхностью раздела. Свойства фаз отличаются друг от друга и примерами таких гетерогенных систем могут являться две несмешивающиеся жидкости, осадок и насыщенный раствор над ним, газ и твердое вещество и др.
Равновесие, устанавливающееся в гетерогенной системе на границе раздела фаз, называется гетерогенным равновесием. Гетерогенная система «осадок – раствор» представляет собой осадок малорастворимого соединения, например, сульфата бария BaSO4, находящийся в равновесии с его насыщенным раствором: BaSO4 (т) ↔ Ba2+ + SO4 2- (р). Напомним, что насыщенным называется раствор, содержащий максимальное количество вещества, которое может раствориться в данном объѐме раствора при данной температуре и давлении. Насыщенный раствор устойчив во времени. Пересыщенный раствор – это раствор, в котором содержится бóльшее количество вещества, чем в насыщенном. Такой раствор неустойчив и избыток вещества выделяется из него в твердую фазу, то есть образуется осадок. Процесс протекает до образования над осадком насыщенного раствора.
Ненасыщенный раствор характеризуется меньшим количеством растворенного вещества, чем насыщенный, и в нем может быть растворено дополнительное количество вещества до получения насыщенного раствора. Концентрация вещества в насыщенном растворе называется растворимостью. Растворимость является количественной характеристикой способности вещества растворяться.Вещества, молярная растворимость которых не превышает 10-2 моль/л, обычно считают малорастворимыми. Примерами малорастворимых солей могут служить сульфат бария BaSO4, карбонат кальция СаСО3, хлорид серебра AgCl, сульфид цинка ZnS, растворимость которых в воде очень мала.
б) Расчеты растворимости и констант произведений растворимости в системе осадок – раствор.
Из уравнения для константы произведения растворимости можно вывести формулу для растворимости веществ. Под растворимостью понимают способность вещества образовывать гомогенную систему с растворителем. Растворимость в аналитической химии применяют в размерности моль/л.
Растворимость осадков – важная величина, которая разрешает определять концентрацию вещества в насыщенном растворе, рассчитать возможность образования осадка при данной ее концентрации.
Если осадок состоит из ионов одинакового заряда (тип АВ), то в растворе над ним концентрацию молекул вещества можно принять равной концентрации ионов, которые образуются из них, так как одна молекула вещества 
AB «A + B
дает один катион и один анион:
[AB] = [A] = [B].
Подставим в выражение концентрационной константы произведения растворимости вместо концентраций [A] и [B] значение концентраций молекул вещества [AB], которое равно растворимости осадка S, получим:
ПРС = [A] ×[B] = [AB][AB] = S × S = S2,
откуда растворимость

Для осадка электролита, который состоит из ионов разных зарядов:
АmВn <=> mA + nВ
ПРС = [A]m [B]n,
[A] = m[AmBn] = m×S;
[B] = n[AmBn] = n×S;
ПРС = (mS)m(nS)n = mmnn × Sm+n;
Откуда растворимость S:

Например, для осадка Ag2CrО4:
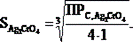
Чем меньше растворимость, тем труднее растворяется электролит и наоборот.
Произведение растворимости многих веществ определено. Если значение ПР неизвестно, то его можно рассчитать по растворимости вещества, найденной по таблице растворимости или определенной экспериментально по концентрации ионов, которые находятся в насыщенном растворе этого вещества (над осадком). Значение ПРСрассчитывают за формулой

При расчетах растворимости следует помнить, что если:
1) ионную силу можно принять равной нулю и протеканием конкурирующих реакций пренебречь, то растворимость осадка рассчитывают по величине ПРТ;
2) влиянием ионной силы пренебречь нельзя (достаточно растворимое соединение или малорастворимое соединение в присутствии посторонних электролитов), но конкурирующие реакции отсутствуют, то растворимость рассчитывают по величине ПРС(Р);
3) конкурирующими реакциями пренебречь нельзя, тогда растворимость рассчитывают по величине ПРУ.
Обычно можно использовать и еще одно приближение: изменение растворимости осадка за счет конкурирующих реакций значительно больше, чем за счет электростатических взаимодействий ионов, поэтому при расчете растворимости осадка в условиях протекания конкурирующих реакций без особых погрешностей коэффициенты активности часто можно принять равными единице:

в) Влияние химических факторов на растворимость малорастворимых электролитов.
Пример 1. Какая растворимость оксалата кальция, если 
Так как, ПРТ достаточно маленькое, то можно пренебречь создаваемой ионной силой. Конкурирующей реакции
С2О42– + Н2О <=> НС2О4– + ОН–;
НС2О4– + Н2О <=> H2C2O4 + OH–.
Так как С2О42– и НС2О4– очень слабые основания, то этими конкурирующими реакциями можно пренебречь.
S S S
CaC2O4 <=> Ca2+ + C2O42–

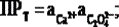

Пример 2. Рассчитайте растворимость оксалата кальция в 0,01 М растворе нитрата калия.
В таком случае величиной ионной силы пренебречь нельзя, так как концентрация постороннего электролита достаточно высокая. Конкурирующими реакциями можно пренебречь.
Рассчитать ионную силу раствора

 =1/2сумма(сi*z^2 I)
=1/2сумма(сi*z^2 I)
-lgfa=(0,5z^2 -sqrt(мю)/(1+sqrt(мю)
За таблицами 
Рассчитываем концентрационное (реальное) ПР при m = 0,01:
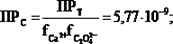

Пример 3. Рассчитайте растворимость оксалата кальция в 1×10-3 М растворе хлоридной кислоты.
Так как среда кислая, необходимо учесть кислотно-основные реакции с участием оксалата-иона:
С2O42– + H+ <=> HC2O4–;
HC2O4– + H+ <=> H2C2O4.
Соответственно CaС2O4<=> Ca2+ + C2O42–.

Рассчитываем a-коэффициент для оксалата-иона при рН = 3,0;

Рассчитываем условную константу произведения растворимости

Пример 4. Рассчитайте растворимость сульфата бария в 0,1 М растворе сульфата натрия.
Для расчета растворимости сульфата бария в данном случае необходимо учесть, что она: а) она уменьшается под действием одноименного иона; б) одновременно увеличивается за счет увеличения ионной силы. Поэтому


Рассчитаем ионную силу, которую создают ионы натрия и сульфата

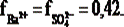 Тогда
Тогда  а
а 
Пример 5. Рассчитать растворимость фосфата магния и аммония в 0,1 М растворе хлорида аммония.
Растворимость фосфата магния и аммония в присутствии хлорида аммония определяется:
а) действием одноименного иона;
б) протеканием конкурирующей реакции
PO43– + NH4+ <=> HPO42– + NH3;
в) увеличением ионной силы.
Первый фактор уменьшает растворимость, два последних – увеличивают. Итак, MgNH4PO4 <=> Mg2+ + NH4+ + PO43–.

Для расчета условного произведения растворимости необходимо рассчитать a-коэффициент PO43--иона. рН раствора задает наличие слабой кислоты NH4+.

[H+] = 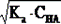 ; [H+] =
; [H+] =  .
.
При этом значении рН рассчитываем a 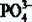 :
:
 .
.
Для ионной силы m = 0,1 находим 
Рассчитываем ПРу = 
Тогда растворимость: S =  M.
M.
В отсутствии посторонних электролитов, в чистой воде, без конкурирующих реакций: 
Пример 6. Рассчитайте растворимость йодида аргентума в 1 М растворе аммиака.
Для расчета растворимости необходимо использовать ПРу, так как протекают конкурирующие реакции: 



Рассчитываем  (для сравнения ПРТ = 9,98×10-17).
(для сравнения ПРТ = 9,98×10-17).
Рассчитываем растворимость AgІ:

10.Пероксид водорода, его получение, кислотные и окислительно-восстановительные свойства (приведите примеры реакций). Пероксокислоты.
Перокси́д водоро́да (перекись водорода), H2O2 — простейший представитель пероксидов. Бесцветная жидкость с«металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны. Пероксид водорода является хорошим растворителем. Из воды выделяется в виде неустойчивогокристаллогидрата H2O2•2H2O.
Молекула пероксида водорода имеет следующее строение:
 Молекула пероксида водорода сильно полярна, что приводит к возникновению водородных связей между молекулами. Связь O—O непрочна, поэтому H2O2 — неустойчивое соединение, легко разлагается. Так же этому может поспособствовать присутствие ионов переходных металлов и серебра:
Молекула пероксида водорода сильно полярна, что приводит к возникновению водородных связей между молекулами. Связь O—O непрочна, поэтому H2O2 — неустойчивое соединение, легко разлагается. Так же этому может поспособствовать присутствие ионов переходных металлов и серебра:
2H2O2 → 2H2O + O2
Однако очень чистый пероксид водорода устойчив.
Пероксид водорода проявляет слабые кислотные свойства (К = 1,4×10−12).
Химические свойства пероксида водорода. Пероксид водорода весьма реакционноспособное вещество, и может проявлять как окислительные так и восстановительные свойства. В водных растворах проявляет слабые кислотные свойства:
H2O2 + H2O <--> H3O+ + HO2—.
a) Окислительные свойства пероксида водорода. Окисление нитрита калия до нитрата:
KNO2 + H2O2 (разб. H2SO4)--> KNO3 + H2O,
выделение иода из иодида калия:
2KI + H2O2 --> I2 + 2KOH,
2KI + H2O2 + H2SO4 --> I2 + K2SO4 + 2H2O.
Окисление сульфида свинца до сульфата применяют в реставрации старых картин, потемневших из-за образования сульфида свинца черного цвета:
PbS + 4H2O2 --> PbSO4 + 4H2O.
б) Восстановительные свойства пероксида водорода. Восстановление оксида серебра:
Ag2O + H2O2 --> 2Ag + O2 + H2O,
взаимодействие с перманганатом калия в кислой среде:
2KMnO4 + 5H2O2 + 3H2SO4 --> 2MnSO4 + 5O2 + K2SO4 + 8H2O.
в) Взаимодействие с основанием приводит к образованию пероксида металла:
Ba(OH)2 + H2O2 --> BaO2 + 2H2O.
г) Реакции компелексоообразования:
H2O2 + TiSO4(OH)2 + K2SO4 (разб. KOH) --> K2[Ti(SO4)2(O22—)](желто-оранж.) + 2H2O,
H2O2 + TiSO4(OH)2 + H2O (разб. H2SO4) --> [Ti(H2O)4(O22—)]SO4 (желт.).
Получение пероксида водорода:
В промышленности:
а)Пероксид водорода получают при реакции с участием органических веществ, в частности, каталитическимокислениемизопропилового спирта:
(CH3)2СН(ОН) + O2 → CH3C(O)CH3 + H2O2
б)Электролиз серной кислоты:
2H2SO4 --> H2 + H2S2O8,
полученная пероксодисерная кислота разлагается водой:
H2S2O8 + 2H2O --> 2H2SO4 + H2O2,
а пероксид водорода отделяется от серной кислоты перегонкой.
В лаборатории перекись водорода получают взаимодействием пероксидов и супероксидов щелочных и щелочно-земельных металлов с кислотами или водой:
Na2O2 + 2H2O --> 2NaOH + H2O2,
2KO2 + 2HCl --> 2KCl + H2O2 + O2,
BaO2 + H2SO4 --> BaSO4 + H2O2.
Применение:
Для более легкого отделения перекиси водорода удобнее использовать для получения перекиси водорода соединениями металлов II-А группы, так как их гидрорксиды и большинство солей нерастворимы в воде.
Благодаря своим сильным окислительным свойствам пероксид водорода нашёл широкое применение в быту и в промышленности, где используется, например, как отбеливатель на текстильном производстве и при изготовлении бумаги. Применяется как ракетное топливо — в качестве окислителя или как однокомпонентное (с разложением на катализаторе). Используется в аналитической химии, в медицине, в качестве пенообразователя при производстве пористых материалов, в производстве дезинфицирующих и отбеливающих средств. В промышленности пероксид водорода также находит свое применение в качестве катализатора, гидрирующего агента, как эпоксидирующий агент при эпоксидировании олефинов. В медицине растворы пероксида водорода применяются как антисептическое средство.
ПЕРОКСОКИСЛОТЫ (надкислоты, перкислоты), кислоты, анион которых содержит пероксогруппу - О-О-. Напр.: пероксоборная НВО3, пероксофосфорная Н3РО5, пероксосерная Н2SО5 (т. н. кислота Каро), пероксодисерная Н2S2О8 (надсерная) кислоты, пероксоуксусная кислота СН3СОООН. Пероксокислоты и их соли - сильные окислители. Пероксосульфаты (персульфаты) аммония (NН4)2S2О8 и калия К2S2О8 - отбеливающие вещества, инициаторы полимеризации.Пероксокислоты важны не только как окислители, но и как промежуточные соединения для получения пероксида водорода. Пероксодисерная кислота получается при электролитическом окислении иона HSO4на холоду. Пероксосерная кислота образуется при гидролизе пероксодисерной кислоты: 2HSO4 -> H2S2O8 + 2e
H2S2O8 + H2O -> H2SO5 + H2SO4
H2SO5+H2O=H2O2+H2SO4
11. Соединения азота с водородом: аммиак, гидразин, гидроксиламин. Получение. Строение молекул. Взаимодействие их с водой, кислотами; окислительно-восстановительные свойства.
а) Аммиак — NH3, нитрид водорода, при нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта), почти вдвое легче воздуха, ядовит.

В жидком аммиаке молекулы связаны между собой водородными связями. Сравнение физических свойств жидкого аммиака с водой показывает, что аммиак имеет более низкие температуры кипения (tкип −33,35 °C) и плавления (tпл −77,70 °C), а также более низкую плотность, вязкость (вязкость жидкого аммиака в 7 раз меньше вязкости воды), проводимость и диэлектрическую проницаемость. Это в некоторой степени объясняется тем, что прочность этих связей в жидком аммиаке существенно ниже, чем у воды, а также тем, что в молекуле аммиака имеется лишь одна пара неподелённых электронов, в отличие от двух пар в молекуле воды, что не дает возможность образовывать разветвлённую сеть водородных связей между несколькими молекулами. Аммиак легко переходит в бесцветную жидкость с плотностью 681,4 кг/м³, сильно преломляющую свет. Подобно воде, жидкий аммиак сильно ассоциирован, главным образом за счёт образования водородных связей. Жидкий аммиак практически не проводит электрический ток. Жидкий аммиак — хороший растворитель для очень большого числа органических, а также для многих неорганических соединений. Твёрдый аммиак — бесцветные кубические кристаллы.
Получение
Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота:
N2(г) + 3H2(г) ↔ 2NH3(г) + 45,9 кДж
Это так называемый процесс Габера
Учитывая все вышеприведённые факторы, процесс получения аммиака проводят при следующих условиях: температура 500 °C, давление 350 атмосфер, катализатор. Выход аммиака при таких условиях составляет около 30 %. В промышленных условиях использован принцип циркуляции — аммиак удаляют охлаждением, а непрореагировавшие азот и водород возвращают в колонну синтеза. Это оказывается более экономичным, чем достижение более высокого выхода реакции за счёт повышения давления.
Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония:
NH4Cl + NaOH = NH3↑ + NaCl + H2O.
Обычно лабораторным способом получают получают слабым нагреванием смеси хлорида аммония с гашеной известью.
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3↑ + 2H2O
Для осушения аммиака его пропускают через смесь извести с едким натром.
Химические свойства
● Благодаря наличию неподеленной электронной пары во многих реакциях аммиак выступает как нуклеофил или комплексообразователь. Так, он присоединяет протон, образуя ион аммония:
NH3 + H+ → NH4+
● Водный раствор аммиака («нашатырный спирт») имеет слабощелочную реакцию из-за протекания процесса:
NH3 + H2O → NH4+ + OH−; Ko=1,8×10−5
● Взаимодействуя с кислотами даёт соответствующие соли аммония:
NH3 + HNO3 → NH4NO3
● Аммиак также является очень слабой кислотой (в 10 000 000 000 раз более слабой, чем вода), способен образовывать с металлами соли — амиды. Соединения, содержащие ионы NH2−, называются амидами, NH2− — имидами, а N3− — нитридами. Амиды щелочных металлов получают, действуя на них аммиаком:
2NH3 + 2К = 2KNH2 + Н2
Амиды, имиды и нитриды ряда металлов образуются в результате некоторых реакций в среде жидкого аммиака. Нитриды можно получить нагреванием металлов в атмосфере азота.
Амиды металлов являются аналогами гидроксидов. Эта аналогия усиливается тем, что ионы ОН− и NH2−, а также молекулы Н2O и NH3 изоэлектронны. Амиды являются более сильными основаниями, чем гидроксиды, а следовательно, подвергаются в водных растворах необратимому гидролизу:
NaNH2 + H2O → NaOH + NH3
CaNH + 2H2O → Ca(OH)2 + NH3↑
Zn3N2 + 6H2O → 3Zn(OH)2 + 2NH3↑
и в спиртах:
KNH2 + C2H5OH → C2H5OK + NH3
Подобно водным растворам щелочей, аммиачные растворы амидов хорошо проводят электрический ток, что обусловлено диссоциацией:
MNH2 → M+ + NH2−
Фенолфталеин в этих растворах окрашивается в красный цвет, при добавлении кислот происходит их нейтрализация. Растворимость амидов изменяется в такой же последовательности, что и растворимость гидроксидов: LiNH2 — нерастворим, NaNH2 — малорастворим, KNH2, RbNH2 и CsNH2 — хорошо растворимы.
● При нагревании аммиак проявляет восстановительные свойства. Так, он горит в атмосфере кислорода, образуя воду и азот. Окисление аммиака воздухом на платиновом катализаторе даёт оксиды азота, что используется в промышленности для получения азотной кислоты:
4NH3 + 3O2 → 2N2 + 6H20
4NH3 + 5O2 → 4NO + 6H2O
На восстановительной способности NH3 основано применение нашатыря NH4Cl для очистки поверхности металла от оксидов при их пайке:
3CuO + 2NH4Cl → 3Cu + 3H2O +2HCl + N2
Окисляя аммиак гипохлоритом натрия в присутствии желатина, получают гидразин:
2NH3 + NaClO → N2H4 + NaCl + H2O
● Галогены (хлор, йод) образуют с аммиаком опасные взрывчатые вещества — галогениды азота (хлористый азот, иодистый азот).
● С галогеноалканами аммиак вступает в реакцию нуклеофильного присоединения, образуя замещённый ион аммония (способ получения аминов):
NH3 + CH3Cl → CH3NH3Cl (гидрохлорид метиламмония)
● С карбоновыми кислотами, их ангидридами, галогенангидридами, эфирами и другими производными даёт амиды. С альдегидами и кетонами — основания Шиффа, которые возможно восстановить до соответствующих аминов(восстановительное аминирование).
● При 1000 °C аммиак реагирует с углём, образуя HCN и частично разлагаясь на азот и водород. Также он может реагировать с метаном, образуя ту же самую синильную кислоту:
CH4 + NH3 + 1,5O2 → HCN + 3H2O
Жидкий аммиак
Жидкий аммиак, хотя и в незначительной степени, диссоциирует на ионы, в чём проявлется его сходство с водой:
2NH3 → NH4+ + NH2−
Константа самоионизации жидкого аммиака при −50 °C составляет примерно 10−33 (моль/л)².
Жидкий аммиак, как и вода, является сильным ионизирующим растворителем, в котором растворяется ряд активных металлов: щелочные, щёлочноземельные, Mg, Al, а также Eu и Yb. Растворимость щелочных металлов в жидком NH3 составляет несколько десятков процентов. В жидком аммиаке NH3 также растворяются некоторые интерметаллиды, содержащие щелочные металлы, например Na4Pb9.
Разбавленные растворы металлов в жидком аммиаке окрашены в синий цвет, концентрированные растворы имеют металлический блеск и похожи на бронзу. При испарении аммиака щелочные металлы выделяются в чистом виде, а щелочноземельные — в виде комплексов с аммиаком [Э(NH3)6] обладающих металлической проводимостью. При слабом нагревании эти комплексы разлагаются на металл и NH3.
Растворенный в NH3 металл постепенно реагирует с образованием амида:
2Na + 2NH3 → 2NaNH2 + H2
Получающиеся в результате реакции с аммиаком амиды металлов содержат отрицательный ион NH2−, который также образуется при самоионизации аммиака. Таким образом, амиды металлов являются аналогами гидроксидов. Скорость реакции возрастает при переходе от Li к Cs. Реакция значительно ускоряется в присутствии даже небольших примесей H2O.
Металлоаммиачные растворы обладают металлической электропроводностью, в них происходит распад атомов металла на положительные ионы и сольватированные электроны, окруженные молекулами NH3. Металлоаммиачные растворы, в которых содержатся свободные электроны, являются сильнейшими восстановителями.
Комплексообразование
Благодаря своим электронодонорным свойствам, молекулы NH3 могут входить в качестве лиганда в комплексные соединения. Так, введение избытка аммиака в растворы солей d-металловприводит к образованию их аминокомплексов:
CuSO4 + 4NH3 → [Cu(NH3)4]SO4
Ni(NO3)2 + 6NH3 → [Ni(NH2)6](NO3)2
Комплексообразование обычно сопровождается изменением окраски раствора, так в первой реакции голубой цвет (CuSO4) переходит в темно-синий (окраска комплекса), а во второй реакции окраска изменяется из зелёной (Ni(NO3)2) в сине-фиолетовую. Наиболее прочные комплексы с NH3 образуют хром и кобальт в степени окисления +3.
Применение
Аммиак относится к числу важнейших продуктов химической промышленности, ежегодное его мировое производство достигает 150 млн. тонн. В основном используется для производства азотных удобрений (нитрат и сульфат аммония, мочевина), взрывчатых веществ и полимеров, азотной кислоты, соды (по аммиачному методу) и других продуктов химической промышленности. Жидкий аммиак используют в качестве растворителя.
В холодильной технике используется в качестве холодильного агента.
б) Гидрази́н (диамид) H2N—NH2 — бесцветная, сильно гигроскопическая жидкость с неприятным запахом.
Молекула N2H4 состоит из двух групп NH2, повёрнутых друг относительно друга, что обусловливает полярность молекулы гидразина, μ = 0,62·10−29Кл · м. Смешивается в любых соотношениях с водой, жидким аммиаком, этанолом; в неполярных растворителях растворяется плохо. Образует органические производные: алкилгидразины и арилгидразины. Был открыт в 1887 году Теодором Курциусом.
Структурная формула гидразина:

СВОЙСТВА:
Термодинамически гидразин значительно менее устойчив, чем аммиак, так как связь N—N не очень прочна: разложение гидразина — экзотермическая реакция, протекающая в отсутствие катализаторов при 200—300 °С:
3N2H4 → 4NH3 + N2
Переходные металлы (Co, Ni, Cu, Ag) катализируют разложение гидразина, при катализе платиной, родием и палладием основными продуктами разложения являются азот и водород:
N2H4 → N2 + 2H2
Благодаря наличию двух неподелённых пар электронов у атомов азота, гидразин способен к присоединению одного или двух ионов водорода. При присоединении одного протона получаются соединения гидразиния с зарядом 1+, двух протонов — гидразония с зарядом 2+, содержащие соответственно ионы N2H5+ и N2H62+. Водные растворы гидразина обладают основными свойствами, но его основность значительно меньше, чем у аммиака:
N2H4 + H2O → [N2H5]+ + OH−, Kb = 3,0 ⋅ 10^ − 6
(для аммиака Kb = 1,78·10−5)
Протонирование второй неподеленной пары электронов протекает ещё труднее:
[N2H5]+ + H2O → [N2H6]2+ + OH−, Kb = 8,4 ⋅ 10^ − 16
Известны соли гидразина — хлорид гидразиния N2H5Cl, сульфат гидразония N2H6SO4 и т. д. Иногда их формулы записывают N2H4 · HCl, N2H4 · H2SO4 и т. д. и называют гидрохлорид гидразина, сульфат гидразина и т. д. Большинство таких солей растворимо в воде.
N2H4 + HCl → [N2H5]Cl
Соли гидразина бесцветны, почти все хорошо растворимы в воде. К числу важнейших относится сульфат гидразина N2H4 · H2SO4.
Гидразин как восстановитель:
Гидразин — энергичный восстановитель. В растворах гидразин обычно также окисляется до азота:
4KMnO4 + 5N2H4 + 6H2SO4 → 5N2 + 4MnSO4 + 2K2SO4 + 16H2O
Восстановить гидразин до аммиака можно только сильными восстановителями, такими, как Sn2+, Ti3+, водородом в момент выделения (Zn + HCl):
N2H4 + Zn + 4HCl → 2NH4Cl + ZnCl2
Получение:
Гидразин получают окислением аммиака NH3 или мочевины CO(NH2)2 гипохлоритом натрия NaClO (метод Рашига):
NH3 + NaOCl → NH2Cl + NaOH
NH2Cl + NH3 → N2H4 * HCl
реакция проводится при температуре 160 °C и давлении 2,5−3,0 МПа.
Синтез гидразина окислением мочевины гипохлоритом по механизму аналогичен синтезу аминов из амидов по Гофману:
(NH2)2CO + NaOCl + 2NaOH → N2H4 + H2O + NaCl + Na2CO3
реакция проводится при температуре ~100 °C и атмосферном давлении.
Применяется также метод Байера:
2NH3 + H2O2 → N2H4 + 2H2
Применение:
Гидразин применяют в органическом синтезе, в производстве пластмасс, резины, инсектицидов, взрывчатых веществ, в качестве компонента ракетного топлива.Гидразин и его производные (метилгидразин, несимметричный диметилгидразин и их смеси (аэрозин)) широко распространены как ракетное горючее.
в) Гидроксилами́н NH2OH — бесцветные кристаллы, легко растворимые в воде с образованием гидрата NH2ОН·Н2О.

Свойства:
● В водном растворе диссоциирует по основному типу, являясь слабым основанием:
NH2OH + H2O → [NH3OH]+ + OH−, Ko = 2·10−8
Может также диссоциировать и по кислотному типу с рКа = 14,02:
NH2OH + H2O → NH2O− + H3O+
В кислом водном растворе гидроксиламин устойчив, однако ионы переходных металлов катализируют его распад.
Подобно NH3, гидроксиламин реагирует с кислотами, образуя соли гидроксиламиния, например: NH2OH + HCl → [NH3OH]Cl
● На воздухе соединение является нестабильным:
3NH2OH → N2 + NH3 + 3H2O
На воздухе легко окисляется кислородом воздуха:
4NH2OH + O2 → 6H2O + 2N2
● Гидроксиламин проявляет свойства восстановителя, при действии на него окислителей выделяются N2 или N2O:
2NH2OH + I2 + 2KOH → N2 + 2KI + 4H2O
● В некоторых реакциях NH2OH проявляются окислительные свойства, при этом он восстанавливается до NH3 или NH4+, например:
N H 2 O H + H 2 S → N H 3 + S + H 2 O
Получение:
В лаборатории получают разложением в вакууме солей гидроксиламина: (NH3OH)3PO4 или [Mg(NH2OH)6](ClO4)2.
Спиртовой раствор гидроксиламина можно получить действием этанола на NH3OHCl.
В промышленности соли гидроксиламина получают восстановлением NO водородом в присутствии платинового катализатора или гидрированием азотной кислоты, а также действием на азотную кислоту атомарным водородом:
HNO3 + 6[ H ] → NH2OH + 2H2O
Применение:
Важнейшей солью гидроксиламина является солянокислый NH2OH·HCl. Он применяется как восстановитель в неорганическом анализе; для количественного определения формальдегида, фурфурола, камфоры, глюкозы; в фотографии и медицине.
Применяется в органическом синтезе. Гидроксиламин, взаимодействуя с альдегидами и кетонами, образует оксимы:R—CH=NOH и R2—C=NOH
12. Электролитическая диссоциация слабых электролитов. Расчет равновесных концентраций ионов в растворах слабых многоосновных кислот.
 2018-01-21
2018-01-21 1940
1940