При сокращении мышцы длина актиновых и миозиновых филаментов не изменяется. Происходит лишь их смещение относительно друг друга: тонкие нити задвигаются в промежуток между толстыми. При этом длина диска А остается неизменной, а диск I укорачивается, полоска Н почти исчезает. Такое скольжение оказывается возможным благодаря существованию поперечных мостиков (миозиновых головок) между толстыми и тонкими нитями. При сокращении возможно изменение длины саркомера приблизительно от 2,5 до 1,7 мкм.
Миозиновая нить имеет на себе множество головок, которыми она может связываться с актином. Актиновая же нить, в свою очередь, имеет участки (активные центры), к которым могут прикрепляться головки миозина. В покоящейся мышечной клетке эти центры связывания прикрыты молекулами тропомиозина, что препятствует образованию связи между тонкими и толстыми нитями.
Для того чтобы актин и миозин могли взаимодействовать, необходимо присутствие ионов кальция. В покое они находятся в саркоплазматическом ретикулуме. Эта органелла представляет собой мембранные полости, содержащие кальциевый насос, который за счет энергии АТФ транспортирует ионы кальция внутрь саркоплазматического ретикулума. Его внутренняя поверхность содержит белки, способные связывать Ca2+, что несколько уменьшает разность концентраций этих ионов между цитоплазмой и полостью ретикулума. Распространяющийся по клеточной мембране потенциал действия активирует близко расположенную к поверхности клетки мембрану ретикулума и вызывает выход Ca2+ в цитоплазму.
Молекула тропонина обладает высоким сродством к кальцию. Под его влиянием она изменяет положение тропомиозиновой нити на актиновой таким образом, что открывается активный центр, ранее прикрытый тропомиозином. К открывшемуся активному центру присоединяется поперечный мостик. Это приводит к взаимодействию актина с миозином. После образования связи миозиновая головка, ранее расположенная под прямым углом к нитям, наклоняется и протаскивает актиновую нить относительно миозиновой приблизительно на 10 нм. Образовавшийся атин-миозиновый комплекс препятствует дальнейшему скольжению нитей относительно друг друга, поэтому необходимо его разъединение. Это возможно только за счет энергии АТФ. Миозин обладает АТФ-азной активностью, то есть способен вызывать гидролиз АТФ. Выделяющаяся при этом энергия разрывает связь между актином и миозином, и миозиновая головка способна взаимодействовать с новым участком молекулы актина. Работа мостиков синхронизирована таким образом, что связывание, наклон и разрыв всех мостиков одной нити происходит одновременно. При расслаблении мышцы активизируется работа кальциевого насоса, что понижает концентрацию Ca2+ в цитоплазме; следовательно, связи между тонкими и толстыми нитями уже не могут образовываться. В этих условиях при растяжении мышцы нити беспрепятственно скользят относительно друг друга. Однако такая растяжимость возможна только в присутствии АТФ. Если в клетке отсутствует АТФ, то актин-миозиновый комплекс не может разорваться. Нити остаются жестко сцепленными между собой. Это явление наблюдается при трупном окоченении.
Существует два режима сокращения мышцы: изотоническое (изменяется длина волокна, а напряжение остается неизменным) и изометрическое (концы мышцы неподвижно закреплены, вследствие чего изменяется не длина, а напряжение).
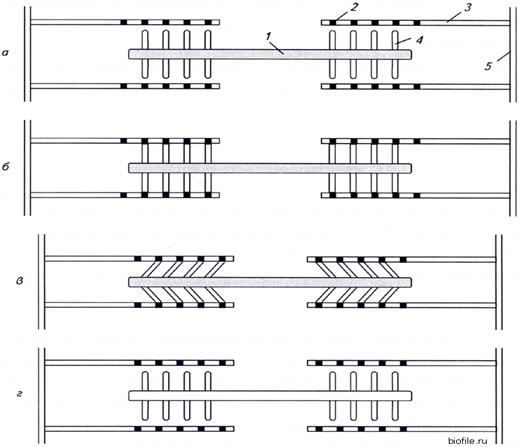
Рисунок: Сокращение саркомера: 1 – миозиновая нить; 2 – активный центр; 3 – актиновая нить; 4 – миозиновая головка; 5 - Z-линия.
а) взаимодействие между тонкими и толстыми нитями отсутствует;
б) в присутствии Ca2+ миозиновая головка связывается с активным центром на актиновой нити;
в) поперечные мостики наклоняются и протаскивают тонкую нить относительно толстой, вследствие чего длина саркомера уменьшается;
г) связи между нитями разрываются за счет энергии АТФ, миозиновые головки готовы взаимодействовать с новыми активными центрами.
 2018-01-21
2018-01-21 1233
1233








