Вначале получим для двухкомпонентной парожидкостной двухфазной системы (компоненты неограниченно растворимы) более удобный вид уравнения равновесной линии. Поскольку в процессе перегонки по высоте аппарата мало меняются мольные расходы пара и жидкости (см. разд.14.1.3.2), то при описании данного процесса удобнее всего измерять концентрацию в мольных долях. Общий вид уравнения равновесной линии для каждого компонента тогда будет следующим:

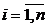 . (14.1)
. (14.1)
Просуммируем уравнения (14.1) по всем n компонентам и учитывая, что сумма мольных долей всех компонентов равна единице, получим
 . (14.2)
. (14.2)
С учетом (14.2) перепишем (14.1) в виде
 . (14.3)
. (14.3)
Обозначив индексами «л» и «т» соответственно легколетучий и труднолетучий компоненты, перепишем (14.3) для двухкомпонентной системы
 , (14.4)
, (14.4)
Поделим числитель и знаменатель (14.4) на коэффициент распределения труднолетучего компонента и введем понятие коэффициента относительной летучести α
 , (14.5)
, (14.5)
 . (14.6)
. (14.6)
Перепишем соотношение (14.5) с использованием мольной доли только легколетучего компонента, опустив при этом для нее индекс «л»
 , (14.7)
, (14.7)
 . (14.8)
. (14.8)
Анализ (14.8) показывает, что коэффициент распределения легколетучего компонента изменяется от  при х =0 до
при х =0 до  , при х =1. Коэффициент относительной летучести в общем случае может быть найден из (14.6) и (12.46)
, при х =1. Коэффициент относительной летучести в общем случае может быть найден из (14.6) и (12.46)
 . (14.9)
. (14.9)
Для умеренных давлений a можно рассчитать с использованием (12.52)
 . (14.10)
. (14.10)
Наконец, для идеальных смесей, у которых все коэффициенты активности равны единице  ,
,
 . (14.11)
. (14.11)
Напомним, что 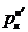 и
и 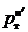
 давления насыщенных паров чистых легколетучего и труднолетучего компонентов при температуре смеси.
давления насыщенных паров чистых легколетучего и труднолетучего компонентов при температуре смеси.
В соответствии с правилом фаз Гиббса (12.3) для двухкомпонентной двухфазной системы число степеней свободы равняется двум
 . (14.12)
. (14.12)
Таким образом, количество независимых параметров, которые можно изменять, не нарушая равновесия, равно двум. Если зафиксировать один из параметров, то произвольно можно будет менять уже только один. Зафиксируем вначале температуру, пусть Т =const. В качестве независимого выбираем состав жидкой фазы
х  мольная доля легколетучего компонента. Тогда давление р и состав паровой фазы y * в условиях равновесия будут зависимыми переменными. Давление в общем случае может быть найдено по уравнению (12.47), а для умеренных давлений можно воспользоваться приближением, полученным из (12.52)
мольная доля легколетучего компонента. Тогда давление р и состав паровой фазы y * в условиях равновесия будут зависимыми переменными. Давление в общем случае может быть найдено по уравнению (12.47), а для умеренных давлений можно воспользоваться приближением, полученным из (12.52)
 . (14.13)
. (14.13)
Воспользуемся этим уравнением для построения диаграммы равновесия р  х, при Т =const. На рисунке 14.1а диаграммы равновесия построены для двух фиксированных температур Т 1 и Т 2, причем
х, при Т =const. На рисунке 14.1а диаграммы равновесия построены для двух фиксированных температур Т 1 и Т 2, причем
Т 2 > Т1. Диаграммы для Т 2 лежат выше, чем для Т 1, так как давления насыщенных паров чистых компонентов  увеличиваются с ростом температуры. Для идеальных смесей зависимость давления от состава линейна, как это следует из (14.13) при
увеличиваются с ростом температуры. Для идеальных смесей зависимость давления от состава линейна, как это следует из (14.13) при 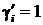 , то есть соответствует закону Рауля (линии 1 и 2). Наклон линий 1 и 2 может быть разным, обычно он уменьшается с ростом температуры. Для неидеальных смесей зависимости р (х) не линейны, так как коэффициенты активности являются функциями состава
, то есть соответствует закону Рауля (линии 1 и 2). Наклон линий 1 и 2 может быть разным, обычно он уменьшается с ростом температуры. Для неидеальных смесей зависимости р (х) не линейны, так как коэффициенты активности являются функциями состава  . Если коэффициенты активности компонентов больше единицы (
. Если коэффициенты активности компонентов больше единицы ( ), то линии
), то линии  и
и  располагаются выше прямых 1 и 2 и такое отклонение называется положительным отклонением от закона Рауля. Если же
располагаются выше прямых 1 и 2 и такое отклонение называется положительным отклонением от закона Рауля. Если же  , то линии
, то линии
 |
Рис. 14.1. Диаграммы парожидкостного равновесия а) р  х и
х и
б) y*  х двухкомпонентной двухфазной системы при Т 1=const и Т 2=const, Т 2> Т 1: 1, 2
х двухкомпонентной двухфазной системы при Т 1=const и Т 2=const, Т 2> Т 1: 1, 2  идеальные смеси;
идеальные смеси;  ,
, 
 неидеальные смеси с положительным отклонением от закона Рауля;
неидеальные смеси с положительным отклонением от закона Рауля;  ,
, 
 неидеальные смеси с отрицательным отклонением от закона Рауля
неидеальные смеси с отрицательным отклонением от закона Рауля
 и
и  располагаются ниже прямых 1 и 2
располагаются ниже прямых 1 и 2  отрицательное отклонение от закона Рауля. Равновесную линию при Т =const легко построить по уравнениям (14.7), (14.11), (14.10) (y*
отрицательное отклонение от закона Рауля. Равновесную линию при Т =const легко построить по уравнениям (14.7), (14.11), (14.10) (y*  x диаграмма на рис. 14.1б).
x диаграмма на рис. 14.1б).
При рассмотрении процесса перегонки удобнее использовать диаграммы равновесия при фиксированном давлении р =const, так как оно изменяется по высоте аппарата незначительно, в то время как температура может меняться существенно. Для построения диаграммы Т  х также можно воспользоваться уравнением (14.13), однако при этом придется решать более сложную обратную задачу: по заданному давлению р при различных х находить Т, учитывая, что
х также можно воспользоваться уравнением (14.13), однако при этом придется решать более сложную обратную задачу: по заданному давлению р при различных х находить Т, учитывая, что  и
и  . Влиянием давления, а, зачастую, и температуры на
. Влиянием давления, а, зачастую, и температуры на  можно пренебречь. Зависимость же
можно пренебречь. Зависимость же  весьма существенная. В среднем при повышении температуры на 10 К давления насыщенных паров возрастают в 1,5
весьма существенная. В среднем при повышении температуры на 10 К давления насыщенных паров возрастают в 1,5  2 раза. Из уравнения (14.13) следует, что зависимость Т (х) будет нелинейной как для неидеальных, так и идеальных смесей (рис. 14.2)
2 раза. Из уравнения (14.13) следует, что зависимость Т (х) будет нелинейной как для неидеальных, так и идеальных смесей (рис. 14.2)
 Рис. 14.2. Диаграммы парожид-костного равновесия Т
Рис. 14.2. Диаграммы парожид-костного равновесия Т  х в двух-компонентных системах при р 1=const, р 2=const, р 2> р 1: 1, 2
х в двух-компонентных системах при р 1=const, р 2=const, р 2> р 1: 1, 2  идеальные смеси;
идеальные смеси; 
 неидеальные смеси с положитель-ным отклонением от закона Рауля;
неидеальные смеси с положитель-ным отклонением от закона Рауля; 
 неидеальные смеси с отрицательным отклонением от закона Рауля; Т л(р), Т т(р)
неидеальные смеси с отрицательным отклонением от закона Рауля; Т л(р), Т т(р)  температуры насыщения (кипе-ния) чистых легколетучего и труднолетучего компонентов при давлении р
температуры насыщения (кипе-ния) чистых легколетучего и труднолетучего компонентов при давлении р
Для построения равновесной линии на y *  х диаграмме при р =const вначале необходимо выполнить предыдущий этап, то есть найти Т (х), а затем для каждого значения Т рассчитать a по (14.11) или (14.10) и, наконец, из (14.7) определить y *(х). Таким образом при р =const a¹const даже для идеальных смесей. Однако для упрощения расчетов идеальных смесей компонентов с незначительно отличающимися температурами кипения иногда считают a=const и находят его как среднее геометрическое из коэффициентов относительной летучести, рассчитанных при температурах кипения чистых компонентов
х диаграмме при р =const вначале необходимо выполнить предыдущий этап, то есть найти Т (х), а затем для каждого значения Т рассчитать a по (14.11) или (14.10) и, наконец, из (14.7) определить y *(х). Таким образом при р =const a¹const даже для идеальных смесей. Однако для упрощения расчетов идеальных смесей компонентов с незначительно отличающимися температурами кипения иногда считают a=const и находят его как среднее геометрическое из коэффициентов относительной летучести, рассчитанных при температурах кипения чистых компонентов
 (14.14)
(14.14)
Для анализа и расчета процесса перегонки часто используют T  x
x  y диаграмму равновесия, на которой при постоянном давлении наносят две линии Т (х)
y диаграмму равновесия, на которой при постоянном давлении наносят две линии Т (х)  линию кипения и Т (y)
линию кипения и Т (y)  линию конденсации (рис. 14.3). С помощью такой диаграммы по одному из известных параметров можно найти два других: по температуре Т 1 определить равновесные составы жидкой х 1 и паровой y 1 фаз; по составу жидкой фазы х 1
линию конденсации (рис. 14.3). С помощью такой диаграммы по одному из известных параметров можно найти два других: по температуре Т 1 определить равновесные составы жидкой х 1 и паровой y 1 фаз; по составу жидкой фазы х 1  температуру Т 1 и состав паровой фазы y 1, по составу паровой фазы y 1
температуру Т 1 и состав паровой фазы y 1, по составу паровой фазы y 1  температуру Т 1 и состав жидкой фазы х 1 (см. рис. 14.3а).
температуру Т 1 и состав жидкой фазы х 1 (см. рис. 14.3а).
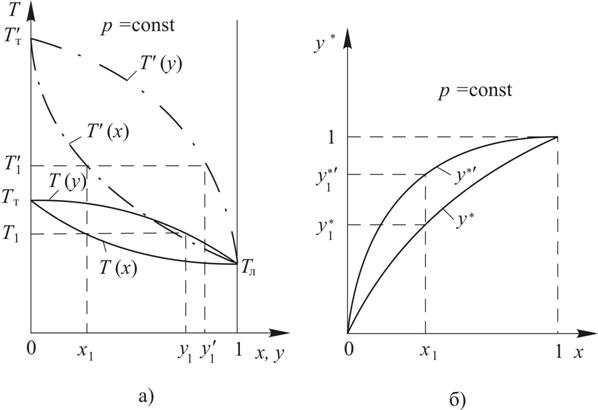 |
Рис. 14.3. Диаграммы парожидкостного равновесия в двухкомпонентных двухфазных системах при р =const для смесей компонентов незначительно (без штрихов) и значительно (со штрихами) отличающихся по летучести
а) Т  х
х  y и б) y*
y и б) y*  x: Т (х), Т' (х)
x: Т (х), Т' (х)  линии кипения; Т (y), Т' (y)
линии кипения; Т (y), Т' (y)  линии конденсации
линии конденсации
Диаграмма Т  х
х  y позволяет наглядно показать процесс простой перегонки. Так если жидкую смесь состава х 1 довести до температуры кипения Т 1, приведя в состояние равновесия с бесконечно малым количеством образовавшегося пара, то его состав будет соответствовать y 1 (рис. 14.3а). Полностью сконденсировав этот пар можно получить жидкий продукт (дистиллят) такого же состава (y 1= хD). Доля легколетучего компонента в паре и, соответственно, в дистилляте будет больше, чем в исходной смеси y 1= хD > х 1. Эффективно осуществлять процесс разделения с помощью простой перегонки возможно лишь для смесей компонентов значительно отличающихся по летучести. Так на рис. 14.3а y' 1 =х'D существенно отличается от х 1, приближаясь к единице, то есть состав дистиллята близок к чистому легколетучему компоненту. Относительная летучесть компонентов зависит от температуры (давления), обычно, увеличиваясь с уменьшением этих величин. Этим пользуются для разделения смесей компонентов незначительно отличающихся по летучести, осуществляя процесс перегонки при пониженном давлении.
y позволяет наглядно показать процесс простой перегонки. Так если жидкую смесь состава х 1 довести до температуры кипения Т 1, приведя в состояние равновесия с бесконечно малым количеством образовавшегося пара, то его состав будет соответствовать y 1 (рис. 14.3а). Полностью сконденсировав этот пар можно получить жидкий продукт (дистиллят) такого же состава (y 1= хD). Доля легколетучего компонента в паре и, соответственно, в дистилляте будет больше, чем в исходной смеси y 1= хD > х 1. Эффективно осуществлять процесс разделения с помощью простой перегонки возможно лишь для смесей компонентов значительно отличающихся по летучести. Так на рис. 14.3а y' 1 =х'D существенно отличается от х 1, приближаясь к единице, то есть состав дистиллята близок к чистому легколетучему компоненту. Относительная летучесть компонентов зависит от температуры (давления), обычно, увеличиваясь с уменьшением этих величин. Этим пользуются для разделения смесей компонентов незначительно отличающихся по летучести, осуществляя процесс перегонки при пониженном давлении.
Особое место с точки зрения перегонки занимают азеотропные смеси. Это сильно неидеальные смеси, у которых при определенном составе хА (точкаазеотропа) состав пара и жидкости в условиях равновесия одинаков y*А=xА. Для таких смесей линии кипения и конденсации на Т  х
х  y диаграмме пересекаются в точке азеотропа с образованием экстремума. Существуют смеси с минимальной и максимальной температурами кипения в точке азеотропа (рис. 14.4), соответствующие, соответственно, положительным и отрицательным отклонениям от закона Рауля. На y
y диаграмме пересекаются в точке азеотропа с образованием экстремума. Существуют смеси с минимальной и максимальной температурами кипения в точке азеотропа (рис. 14.4), соответствующие, соответственно, положительным и отрицательным отклонениям от закона Рауля. На y  x диаграмме линия равновесия в точке азеотропа пересекает диагональ (рис. 14.5).
x диаграмме линия равновесия в точке азеотропа пересекает диагональ (рис. 14.5).
 |
Рис. 14.4. Диаграммы парожидкостного равновесия Т  х
х  y в двухкомпонентных двухфазных системах при р =const для азеотропных смесей с а) минимальной и б) максимальной температурами кипения в точке азеотропа А
y в двухкомпонентных двухфазных системах при р =const для азеотропных смесей с а) минимальной и б) максимальной температурами кипения в точке азеотропа А
 |
Рис. 14.5. Диаграммы парожидкостного равновесия y *  х в двухкомпонентных двухфазных системах при р =const для азеотропных смесей с а) минимальной и б) максимальной температурами кипения в точке азеотропа А
х в двухкомпонентных двухфазных системах при р =const для азеотропных смесей с а) минимальной и б) максимальной температурами кипения в точке азеотропа А
Одной из особенностей азеотропных смесей является наличие области составов, в которой доля легколетучего компонента в равновесном паре меньше, чем в жидкости. В смесях с минимумом температуры кипения эта область располагается при х>хА, а в смесях с максимумом температуры кипения  при х<хА.
при х<хА.
Основной особенностью азеотропных смесей является невозможность разделения их с помощью перегонки в точке азеотропа, так как образующийся пар будет обладать таким же составом, что и жидкость y * А=хА. Состав точки азеотропа зависит от давления. Изменяя давление можно смещать точку азеотропа на равновесной кривой, что в некоторых случаях предоставляет возможность достигать необходимой степени разделения смеси путем перегонки. Как будет показано ниже (разд. 14.2), существуют специальные виды перегонки с добавлением дополнительных компонентов, позволяющие разделять азеотропные смеси.
Мы рассматривали смеси компонентов неограниченно растворимых друг в друге (жидкость гомогенная). Теперь остановимся на ограниченно растворяющихся жидкостях. При малых концентрациях легколетучего или труднолетучего компонента их жидкая смесь является гомогенным раствором. Однако существует область составов, в которой жидкость расслаивается на две фазы I и II. В таком случае при парожидкостном равновесии для двухкомпонентной системы будут сосуществовать три фазы  одна паровая и две жидких.
одна паровая и две жидких.
В соответствии с правилом фаз Гиббса (12.3) для двухкомпонентной трехфазной системы число степеней свободы будет равно единице
 . (14.15)
. (14.15)
Таким образом, зафиксировав, например, давление р в условиях равновесия все остальные параметры в области расслаивания должны иметь строго определенные значения: Т р,  , x I, x II. Две последние величины характеризуют мольные доли легколетучего компонента в двух жидких фазах I и II. Это значит, что в области расслаивания состав жидких фаз постоянен
, x I, x II. Две последние величины характеризуют мольные доли легколетучего компонента в двух жидких фазах I и II. Это значит, что в области расслаивания состав жидких фаз постоянен
(x I, x II) и добавление в систему одного из компонентов изменяет лишь соотношение количества веществ в фазах, но не их состав. Постоянны в области сосуществования двух жидких фаз равновесный состав пара y * и температура Т р. В зависимости от соотношения x I, x II и  возможны два случая: с наличием гетерогенного азеотропа и в отсутствии такового. Если
возможны два случая: с наличием гетерогенного азеотропа и в отсутствии такового. Если  > x I, x II, то азеотропа не будет (рис. 14.6), если же
> x I, x II, то азеотропа не будет (рис. 14.6), если же  находится в промежутке от x I до x II, то при
находится в промежутке от x I до x II, то при

Рис. 14.6. Диаграммы парожидкостного равновесия в двухкомпонентных двухфазных системах при р =const для смесей компонентов с ограниченной растворимостью, не образующих азеотроп а) Т  х
х  y и
y и
б) y *  x: области x < x I, x > x II
x: области x < x I, x > x II  двухфазные; x I< x < x II
двухфазные; x I< x < x II  трехфазная
трехфазная
некотором соотношении компонентов xА образуется азеотроп (рис. 14.7). Необходимо отметить, что на рис. 14.6 и 14.7 x  доля легколетучего компонента в жидкости в целом, т.е. при расслаивании
доля легколетучего компонента в жидкости в целом, т.е. при расслаивании  в совокупности обеих жидких фаз.
в совокупности обеих жидких фаз.
При увеличении доли легколетучего компонента вплоть до x I (рис. 14.6, 14.7) жидкая фаза является гомогенной и диаграммы равновесия имеют обычный вид. При x > x I начинается расслаивание жидкости на 2 фазы с составами x I и x II. При добавлении в систему легколетучего компонента состав фаз остается постоянным, изменяется лишь пропорция между количеством вещества в фазах (уменьшается количество вещества в фазе состава x I и увеличивается в фазе x II). Постоянны при этом также температура Т р и состав пара y р. По достижении доли легколетучего компонента в жидкости x II жидкость вновь становится гомогенной и при дальнейшем увеличении x меняется как температура Т, так и равновесный состав паровой фазы y *.

Рис. 14.7. Диаграммы парожидкостного равновесия в двухкомпонентных двухфазных системах при р =const для смесей компонентов с ограниченной растворимостью, образующих гетерогенный азеотроп А
а) Т  х
х  y и б) y *
y и б) y *  x: области x < x I, x > x II
x: области x < x I, x > x II  двухфазные; x I< x < x II
двухфазные; x I< x < x II  трехфазная
трехфазная
Необходимо отметить, что ограниченная растворимость компонентов наблюдается в некотором диапазоне температур (давлений). Обычно при увеличении температуры взаимная растворимость компонентов возрастает и по достижении критической температуры растворения компоненты растворяются друг в друге неограниченно.
 2018-01-21
2018-01-21 2921
2921








