Классификация
1– В зависимости от числа замещенных атомов водорода аммиака различают амины:
– первичные содержат аминогруппу (–NH2), общая формула: R–NH2,
– вторичные содержат аминогруппу (–NH),
общая формула: R1–NH–R2
– третичные содержат атом азота, общая формула: R3–N
Известны также соединения с четвертичным атомом азота: четвертичный гидроксид аммония и его соли.
2– В зависимости от строения радикала амины различают:
– алифатические (предельные и непредельные)
– алициклические
– ароматические (содержащие в ядре аминогруппу или боковой цепи)
– гетероциклические.
Способы получения аминов
Амины могут быть получены различными способами.
А) Действием на аммиак галогеналкилами
2NH3 + CH3I ––® CH3– NH2 + NH4I
Б) Каталитическое гидрирование нитробензола молекулярным водородом:
3Н2
С6Н5NО2 ––® С6Н5NН2 + Н2О
нитробензол кат анилин
В) Получение низших аминов (С1–С4) путем алкилирования спиртами:
3500C, Al2O3
R–OH + NH3 –––––––––––® R–NH2 +H2O
3500C, Al2O3
2R–OH + NH3 –––––––––––® R2 –NH +2H2O
3500C, Al2O3
3R–OH + NH3 –––––––––––® R3–N + 3H2O
Физические свойства аминов
Метиламин, диметиламин и триметиламин — газы, средние члены ряда аминов — жидкости, высшие — твердые тела. С увеличением молекулярной массы аминов увеличивается их плотность, повышается температура кипения и уменьшается растворимость в воде. Высшие амины в воде нерастворимы. Низшие амины имеют неприятный запах, несколько напоминающий запах испорченной рыбы. Высшие амины или не имеют запаха, или обладают очень слабым запахом. Ароматические амины представляют собой бесцветные жидкости или твердые вещества, обладающие неприятным запахом и ядовиты.
Химические свойства аминов
Химическое поведение аминов определяется наличием в молекуле аминогруппы. На внешней электронной оболочке атома азота имеется 5 электронов. В молекуле амина также, как и в молекуле аммиака, атом азота затрачивает на образование трех ковалентных связей три электрона, а два остаются свободными.
Наличие свободной электронной пары у атома азота дает ему возможность присоединять протон, поэтому амины подобны аммиаку, проявляют основные свойства, образуют гидроксиды, соли.
Солеобразование. Амины с кислотами дают соли, которые под действием сильного основания вновь дают свободные амины:
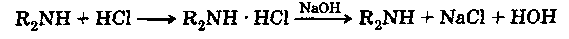
|
Аналогично строению молекулы хлорида аммония можно представить и строение солей аминов:
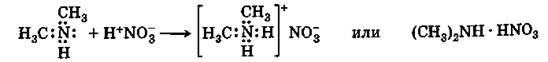
|
Амины дают соли даже со слабой угольной кислотой:
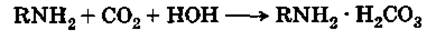
|
При растворении амина в воде часть протонов воды расходуется на образование катиона; таким образом, в растворе появляется избыток гидроксид-ионов, и он имеет щелочные свойства, достаточные для окрашивания растворов лакмуса в синий цвет и фенолфталеина в малиновый. Основность аминов предельного ряда колеблется в очень небольших пределах и близка к основности аммиака.
Соли аминов следует рассматривать как комплексные соединения. Центральным атомом в них является атом азота, координационное число которого равно четырем. Атомы водорода или алкилы связаны с атомом азота и расположены во внутренней сфере; кислотный остаток расположен во внешней сфере.
Действие на амины азотистой кислоты. Эта реакция имеет важное аналитическое значение, так как позволяет различать первичные, вторичные и третичные амины неароматического характера.
При действии азотистой кислоты на первичные амины (кроме ароматических аминов) выделяется свободный азот и образуется чаще всего спирт:
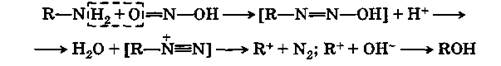
|
Вторичные амины с азотистой кислотой дают нитрозоамины — желтоватые жидкости, мало растворимые в воде:
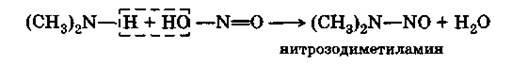
|
Диамины
Диамины играют важную роль в биологических процессах. Как правило, они легко растворимы в воде, обладают характерным запахом, имеют сильно щелочную реакцию, взаимодействуют с С02 воздуха. Диамины образуют устойчивые соли с двумя эквивалентами кислоты.
 2017-11-01
2017-11-01 487
487






