
р,  - сопряженная система
- сопряженная система
Длина связи С=О – 0,118 – 0,126 нм
Длина связи С – О – 0,121 – 0,137 нм
Угол О – С – О – 118 – 1250С
ХИМИЧЕСКИЕ СВОЙСТВА
Реакционные центры

1. Кислотный характер карбоновых кислот:

Стабильность карбоксилат-иона:

Влияние ЭД-ных заместителей на кислотные свойства:

Влияние ЭА-ных заместителей на кислотные свойства:

Карбоновые кислоты образуют соли:
cоли кислот от С11 и выше называются мылами:

2. Основные свойства карбоновых кислот
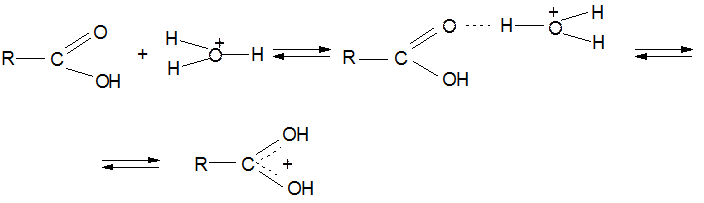
3. Образование амидов:
R – COOH + NH3 → R – CONH2 + H2O
Амиды - кристаллические вещества (кроме формамида НСОNН2).
4. Образование галогенангидридов кислот с помощью РCl5, PCl3, SOCl2:

Реакция S – ацилирования тиолов



6. Реакция этерификации:
R – COOH + R1OH  R – COOR1 + H2O
R – COOR1 + H2O
Механизм реакции:

7. Образование ангидридов:
2R – C(О) – OH  R – C(О) – O – C(О) – R + H2O
R – C(О) – O – C(О) – R + H2O

Ангидриды кислот характеризуются большой активностью, являются ацилирующими агентами.
Среди производных карбоновых кислот в организме чаще всего встречаются их сложные эфиры, тиоэфиры и амиды.
Галогенангидриды и ангидриды карбоновых кислот в организме не обнаружены.
Производные карбоновых кислот склонны к взаимопревращениям за счет реакций нуклеофильного замещения:

возрастание реакционной способности в процессах гидролиза
 2017-11-01
2017-11-01 480
480








