а) пиролиз солей щелочных металлов
R – C(О) – ONa + NaOH  RH + Na2CO3
RH + Na2CO3
б) реакция Пириа:
(R – COOH) 2Ca  R – C(О) – R +
R – C(О) – R +
+ CaCO3
в) реакция Кольбе (электролиз):
2RCOOH +2H2O  R – R + 2CO2+ H2
R – R + 2CO2+ H2
Г) декарбоксилирование муравьиной кислоты
НСООН 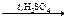 Н2О + СО
Н2О + СО
9. α-Галогенирование; в этой реакции проявляются электроноакцепторные свойства карбоновых кислот:

Hal: Cl, Br, I, F.
10. Восстановление до соответствующих альдегидов и первичных спиртов:
R – COOH  R – CH=N – CH3
R – CH=N – CH3 
→ R – CHO
R – C(О) – OC2H5 + 3C2H5OH + 4Na →
→ RCH2OH + 4C2H5ONa
Окисление
| а) | 
|
б) HCOOH + HgCl2 → Hg + CO2 + 2HCl
HCOOH + 2[Ag(NH3)2]OH → 2Ag + NH4HCO3 + 3NH3 + H2O
HCOOH + Cl2 → CO2 + 2HCl
Некоторые специфические свойства
Ненасыщенных кислот, реакции в углеводородном остатке
| а) | 
|
| б) | 
|
Дикарбоновые кислоты
Это органические соединения, содержащие две карбоксильные группы.
КЛАССИФИКАЦИЯ:
Алифатические
● насыщенные


● ненасыщенные

● ароматические

Диссоциация дикарбоновых кислот:


ХИМИЧЕСКИЕ СВОЙСТВА
1. Кислотные свойства:

2. Этерификация:

3. Декарбоксилирование:

4. Специфические реакции:



5. СН – кислотные свойства


Синтез одноосновных карбоновых кислот:

Получение двухосновных карбоновых кислот:
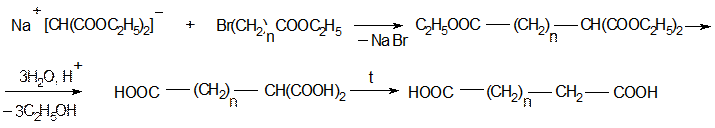
6. Реакции фталевых кислот:



 2017-11-01
2017-11-01 705
705







