(кислот и оснований)
Сильные электролиты – все кислоты и основания, константы ионизации которых больше 10–2.
В водных растворах концентрации ионов Н+ и ОН– взаимосвязаны выражением ионного произведения воды
Кв = Кд×[H2O] = 1,8×10–16×55,49 = 10–14
[H+] × [OH–] = 10–14
В чистой воде или нейтральном растворе
[H+] = [OH–] = 10–7 моль/л
В кислой среде
[H+] > 10–7,[OH–] < 10–7
В щелочной среде
[H+] < 10–7,[OH–] > 10–7
Для расчета концентрации ионов Н+ или ОН– используют значение отрицательного логарифма, который называется водородным или гидроксильным показателем соответственно
рН = –lg[H+] pOH = –lg[OH–]
Так как [H+] × [OH–] = 10–14, то для водных растворов выполняется соотношение
рН + рОН = 14
В растворах сильных электролитов (a~1) молярная концентрация ионов Н+ и ОН– практически равна молярной концентрации кислоты или основания и определяется как
[H+] = Ск–ты×a ~ Cк–ты, [ОН–] = Сосн×a ~ Cосн
Для количественной характеристики реакции среды раствора сильного электролита используется водородный показатель
рН = –lg a (H+),
где а (Н+) – активность ионов водорода, определяется как
а (Н+) = g(Н+)?[Н+],
где [Н+] – равновесная молярная концентрация ионов Н+, g(Н+) – коэффициент активности ионов водорода, определяемый по правилу ионной силы (определяется из таблиц).
Для расчета рН щелочей используют соотношение
рН = 14 – рОН,
где рОН = –lg a (OH-).
Пример 1. Рассчитайте рН 0,01 М раствора серной кислоты.
Решение. Серная кислота – H2SO4 – сильная двухосновная кислота, в растворе полностью распадается на ионы, и уравнение диссоциации записывают как необратимый процесс
H2SO4 ® 2H+ + 
Согласно уравнению при полном распаде на ионы концентрация ионов  составит 0,01 моль/л, а концентрация ионов [Н+] – в 2 раза больше, т.е. 0,02 моль/л.
составит 0,01 моль/л, а концентрация ионов [Н+] – в 2 раза больше, т.е. 0,02 моль/л.
Расчет рН следует проводить по формуле
рН = –lg a (H+) = –lg (g(Н+)?[Н+])
Для определение коэффициента активности находим ионную силу раствора составит:

Коэффициент активности 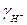 (находим из справочной литературы) =0,9
(находим из справочной литературы) =0,9
Тогда величина рН раствора серной кислоты составит
рН = –lg a (H+) = –lg (g(Н+)?[Н+]) = –lg(0,9?0,06) = 1,27
Если пренебречь активностью ионов водорода, то
рН = –lg[H+] = –lg0,06 = 1,22
Пример 2. Рассчитайте рН раствора гидроксида бария Ва(ОН)2, в 2 л которого содержится 1,713 г безводного гидроксида бария.
Решение. Ва(ОН)2 – щелочь, сильный электролит, в растворе полностью диссрциирует по уравнению
Ва(ОН)2 ® Ва2+ + 2ОН–
Для определения молярной концентрации [ОН–], вычислим молярную концентрацию щелочи

Согласно уравнению при полном распаде на ионы концентрация ионов Ва2+ составит 0,005 моль/л, а концентрация ионов [ОН–] – в 2 раза больше, т.е. 0,01моль/л.
Для расчета рН щелочей используюем соотношение
рН = 14 – рОН = 14 + lg a (OH-) = 14 + lg(g(OH–)?[OН–])
Рассчитаем ионную силу раствора:

Коэффициент активности  (находим из справочной литературы) = 0,87
(находим из справочной литературы) = 0,87
Тогда величина рН раствора Ва(ОН)2 составит
рН = = 14+lg(0,87?0,01) = 11,93
Пример 3. Рассчитайте, как изменится рН 0,01 М раствора гидроксида натрия, если в 1 л такого раствора растворить 0,5845 г хлорида натрия.
Решение. NaOH – сильный электролит, щелочь. При добавлении к раствору щелочи сильного электролита NaCl молярная концентрация ОН– не изменится. Однако возрастет ионная сила раствора, что приведет к уменьшению коэффициента активности ионов, снижению активности ионов  и, следовательно, к изменению рН раствора.
и, следовательно, к изменению рН раствора.
1. Рассчитаем сначала рН чистого раствора щелочи. Так как диссоциация протекает полностью согласно уравнению
NaOH ó Na+ + OH-,
то [OH–] равна молярной концентрации NaOH, и составляет 0,01 моль/л.
При величине ионной силы данного раствора

коэффициент активности равен 0,9.
Тогда 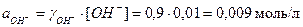 , а
, а
рОН = –lg  –lg0,009 = 2,05
–lg0,009 = 2,05
рН = 14 – рОН = 14 – 2,05 = 11,95
2. Теперь рассчитаем рН после добавления в раствор NaOH соли хлорида натрия. В водном растворе хлорид натрия диссоциирует нацело:
NaCl ® Na+ + Cl–,
что дает в раствор  .
.
Следовательно, ионная сила такого раствора с учетом всех видов ионов станет равной:

При такой ионной силе коэффициент активности равен 0,8.
Тогда  , а
, а
рОН = –lg  –lg0,008 = 1,1
–lg0,008 = 1,1
рН = 14 – рОН = 14 – 1,1 = 11,9.
Таким образом, рН раствора уменьшится с 11,95 до 11,9.
Слабые электролиты – кислоты и основания, константы ионизации которых меньше 10–4.
Концентрации ионов Н+ (ОН–) и, следовательно, рН растворов слабых кислот (оснований) определяется не только концентрацией раствора, но и константой ионизации кислоты (основания), т.е. природой электролита.
Степень диссоциации (a) слабых электролитов связана с их концентрацией в растворе законом разбавления Оствальда
 ,
,
где Кд – константа диссоциации (ионизации) слабой кислоты Кк–ты или слабого основания Косн, С – молярная концентрация (моль/л).
Для расчета рН растворов слабых многоосновных кислот и многокислотных оснований используют, в основном, константу диссоциации по первой ступени.
Для слабой кислоты
[H+] = a×Cк–ты =  ,
,
рН = –lg[H+] = –lg  = ½ (pКк–ты – lgСк–ты)
= ½ (pКк–ты – lgСк–ты)
Для слабого основания
[ОН–] = a×Cосн =  ,
,
рН = 14 – рОН = 14 + lg[ОH–] = 14 + lg  = 14 – ½ (pКосн – lgСосн)
= 14 – ½ (pКосн – lgСосн)
Для электролитов, константы ионизации которых больше 10–4, используется более строгое уравнение Оствальда расчета степени ионизации:
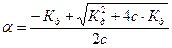
Пример 4. Рассчитайте рН 0,001 М раствора селеноводородной кислоты.
Решение. Селеноводородныя кислота – H2Sе – слабая двухосновная кислота, в растворе диссоциирует ступенчато:
1-я ступень:H2Sе ó H+ + HSe–, Кд1 = 1,55?10–4
2-я ступень: HSe– ó H+ + Se2–, Кд2 = 1?10–11
При расчетах рН растворов слабых электролитов можно с достаточной степенью точности использовать формулу
рН = –lg[H+]
В соответствии с уравнением диссоциации по первой ступени концентрация ионов Н+ равна концентрации HSe– и концентрации диссоциированных молекул H2Se. Тогда, по определению:  ,
,
[H+] = a?cкислоты =  =
=  3,937?10–4
3,937?10–4
рН = –lg[H+] =–lg3,937?10–4 = 3,4
Пример 5. Рассчитайте концентрацию раствора муравьиной кислоты с рН равным 3. Решение. Муравьиная кислота НСООН – слабый электролит, диссоциирует обратимо по уравнению
HCOOH ó H+ + HCOO–, Кд = 1,8?10–4
Из уравнения диссоциации видно, что при диссоциации одной молекулы кислоты возникает один катион Н+ и один анион НСОО–. Так как по условию рН раствора равен 3, то концентрация данных ионов составляет [H+] = =[HCOO–] = 10–3 моль/л. При этом концентрация диссоциированной кислоты также составляет 10–3 моль/л. Обозначив исходную концентрацию кислоты через х и учитывая, что в начальный момент продуктов диссоциации не было, находим, что при равновесии концентрация недиссоциированной кислоты [HCOOH] = (x – 10–3) моль/л.
Запишем выражение для константы диссоциации муравьиной кислоты и подставим значения равновесных концентраций
 ,
,
откуда х = 0,0055 моль/л, что соответствует молярной концентрации кислоты.
Пример 6. Рассчитайте, как изменится рН 0,01 М раствора NH4ОH при разбавлении его в 100 раз.
Решение. NH4ОН – слабый электролит, диссоцииует обратимо по уравнению:
NH4OH ó  + OH–
+ OH–
Из уравнения диссоциации следует, что для расчета рН следует рассчитать равновесную концентрацию ОН–, а затем воспользоваться соотношением
рН = 14 – рОН
Найдем рН 0,01 М раствора NH4ОН, Кд = 1,76?10–5
[OH–] = a?cосн = 
Тогда,
рН = 14 + lg[OH–] = 14 + lg4,2?10–4 = 10,62
Теперь рассчитаем рН раствора, разбавленного в 100 раз, т.е. при концентрации NH4ОН равной 10–4 моль/л:
[OH–] = a?cосн = 
Тогда,
рН = 14 + lg[OH–] = 14 + lg4,2?10–5 = 9,62
Таким образом, при разбавлении раствора происходит уменьшение величины рН.
 2017-11-01
2017-11-01 56243
56243