Для расчёта констант скоростей элементарных реакций можно использовать уравнение Аррениуса, где предэкспонент А и энергия активации E являются постоянными в определённом диапазоне температур. Несмотря на большое число различных элементарных реакций, константы скорости их поддаются оценке и расчёту на основе термодинамических данных.
Все реакции, описывающие пиролиз углеводородов, являются обратимыми. Используя принцип детального равновесия к элементарным реакциям и зная кинетические параметры прямой реакции, можно определить их и для обратной реакции:
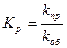 (41)
(41)
 (42)
(42)
где Кр – константа равновесия; Kпр и Kоб – константы скорости прямой и обратной реакции соответственно; ΔHT, ΔST - изменение энтальпии и энтропии при температуре, Т; Т – температура, К; К – газовая постоянная, равная 8,314 Дж/(моль . К)
С другой стороны, из уравнения Аррениуса для kпр и kоб
 (43)
(43)
где Апр и Аоб – предэкспоненты прямой и обратной реакции соответственно, с-1; Епр и Еоб – энергия активации прямой и обратной реакции соответственно, Дж/моль.
Из уравнений (42) и (43):
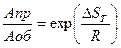 ;
;  (44)
(44)
Таким образом, по изменению энтальпии и энтропии в ходе реакции можно определить соотношения предэкспонент и энергий активаций. При температурах, отличных от стандартной, необходимо учитывать зависимости энтальпии и энтропии от температуры:
 (45)
(45)
 (46)
(46)
где ΔH0, ΔS0 – изменение энтальпии и энтропии при стандартной температуре (293,16 К); Δcp – изменение теплоёмкости, Дж/(моль . К).
Хотя теплоёмкости веществ сильно зависят от температуры и могут иметь большую величину, Δcp для реакции слабо зависит от температуры и численное значение её невелико. На этом основании интегралы в формулах (45) и (46) могут быть заменены на средние величины Δcp. Тогда:
 (47)
(47)
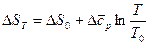 (48)
(48)
где Δср – изменение средней теплоёмкости, Дж/моль . К.
Здесь следует отметить, что как правило, в таблицах даны численные значения термодинамических величин, отнесённые к стандартному состоянию идеального газа при 298 К и 0,101 МПа. При переходе к единицам концентрации в моль/л величины ΔHТ и ΔSТ изменятся для реакций, идущих с изменением числа молей, соответственно уравнениям:
 (49)
(49)
 (50)
(50)
где Δn – изменение числа молей; с – при стандартном состоянии для идеального газа 1 моль/л; p – при стандартном состоянии (для идеального газа при 0,101 МПа); R – газовая постоянная, равная 8,314 Дж/(моль . К).
Огромный экспериментальный материал по параметрам констант скоростей, имеющийся в литературе, позволяет сделать ряд обобщений. Так, реакции рекомбинации радикалов идут практически без энергии активации. Поэтому обратные им реакции распада углеводородов должны иметь энергию активации, весьма близкую к прочности разрываемой связи. Реакции присоединения атомов водорода к олефинам имеют энергию активации, равную 10,8 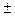 0,85 кДж/моль. Для аналогичных реакций с метильным радикалом она составляет 31,4
0,85 кДж/моль. Для аналогичных реакций с метильным радикалом она составляет 31,4 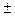 2,10 кДж/моль.
2,10 кДж/моль.
На основании обработки большого объёма экспериментальных данных и теоретических предпосылок был создан ряд полуэмпирических методов расчёта предэкспонент и энергий активации. Так, используя допущение об аддитивности энергий связи в переходном комплексе Ф.Б. Моиным был предложен метод расчёта энергий активации, который даёт хорошую согласованность при сравнении с экспериментальными данными. Для расчёта предэкспонент бимолекулярных реакций может быть использован метод Мулявы и Шевчука.
 2017-11-01
2017-11-01 470
470








