1. Рассчитайте молярную концентрацию соляной кислоты в растворе с массовой долей НС1 38% (плотность раствора 1,19 г/мл).
2. Хлорид кальция используют в медицине при недостаточной функции паращитовидных желез, сопровождающейся тетанией или спазмофилией (заболеванием у детей, связанном с уменьшением содержания в крови ионов кальция и защелачиванием крови); при усиленном выделении кальция из организма, что может иметь место при длительном обездвиживании больных. Сколько грамм кристаллического СаС12 • 6Н2О и воды потребуется для приготовления 250 мл 10% раствора (плотность раствора равна 1 г/мл)? Какова молярная концентрация этого раствора?
3. Определите молярную концентрацию и молярную концентрацию эквивалента 4 % раствора гидрокарбоната натрия, плотностью 1,102 г/мл, который оказывает антацидное действие, стимулирует отхаркивание.
4. В 200 мл воды растворили 5 г тетрагидрата хлорида бериллия. Вычислите для этого раствора: а) титр, б) молярную концентрацию, в) молярную концентрацию эквивалента, г) моляльную концентрацию, д) массовую долю хлорида бериллия, если плотность раствора 1,90 г/мл.
5. Вычислите массу муравьиной кислоты, находящийся в растворе, если известно, что на титрование 20 мл было затрачено 15 мл раствора гидроксида калия с молярной концентрацией, равной 0,05 моль/л.
6. Рассчитать осмотическое давление раствора при 27°С, содержащего 35 г сахарозы в 560 мл раствора.
7. Каким (гипо-, гипер-, изотоническим) является 5% раствор глюкозы (плотность 1,08 г/мл) при 310 К, применяемый для внутривенного введения при отеке легких, если осмотическое давление плазмы крови 780 кПа?
8. Вычислите осмотическое давление раствора магния хлорида применяемого в качестве противовоспалительного, метаболического, бактерицидного средства, с массовой долей 3,8 % при 25 °С, если плотность раствора равна 1,316 г/мл, i=1,35.
9. Вычислить температуру кипения и замерзания 0,9% изотонического раствора хлорида натрия, если изотонический коэффициент равен 1,85 (эбулиоскопическая константа воды равна 0,52; криоскопическая константа воды равна 1,86 град кг/моль).
10. Рассчитать ионную силу раствора содержащего в 300 мл 15 г фосфата кальция, применяемого для восполнения дефицита кальция и фосфора при остеопорозе и остеомаляции алиментарной недостаточности, беременности и лактации, при недостаточности паращитовидных желез.
11. Укажите какие из приведенных ниже солей будут подвергаться гидролизу: CaSO4, СН3СООК, NaNO3, A1C13. Напишите уравнения гидролиза в молекулярном и ионном виде, укажите реакцию среды.
12. Вычислить рН гидроксида калия с концентрацией 0,03 моль/л.
13. Вычислить рН 0,04 моль/л раствора соляной кислоты.
14. Рассчитайте рН желудочного сока, если массовая доля соляной кислоты в нем составляет 0,30%. Плотность желудочного сока принять равной 1 г/мл.
15. Рассчитать рН ацетатного буферного раствора, приготовленного из 50 мл 0,02 моль/л раствора уксусной кислоты и 75 мл 0,05 моль/л раствора ацетата натрия. Кдис.(СН3СООН) = 1,8·10-5.
16. Вычислите рН аммиачного буферного раствора, содержащего 100 мл раствора гидроксида аммония с концентрацией 0,2 моль/л и 300 мл раствора хлорида аммония с концентрацией 0,3 моль/л. К b=1,79 ∙ 10-5, рК b =4,75.
17. Рассчитать емкость буферного раствора по кислоте, если при добавлении к 40 мл этого раствора 8 мл соляной кислоты с концентрацией 0,6 моль/л рН изменится от 7,3 до 7.
18. Образуется ли осадок при смешивании 0,03 моль/л раствора сульфата калия с равным объемом 0,08 моль/л раствора хлорида стронция, если произведение растворимости сульфата стронция равно 3,2·10-7?
19. Образуется ли осадок при смешивании 100 мл раствора хлорида кальция с молярной концентрацией 5,0∙10-3 моль/л и 50 мл фосфата натрия с молярной концентрацией 2,0∙10-3 моль/л. Ks (Ca3 (PO4)2) = 2,0∙10-29.
20. Температурный коэффициент скорости реакции равен 2,5. Как изменится скорость реакции при понижении температуры от 80 до 30°С?
21. Вычислите скорость реакции, протекающей по уравнению: А+3В = Д, если [А]=4 моль/л, [В] = 8 моль/л, k = 0,02 л2/моль2мин. Как изменится скорость реакции, если давление уменьшить в 4 раза?
22. Константа скорости гидролиза аспирина при 25°С составляет 0,002 ч -1 (при рН = 1,8). Рассчитайте период полупревращения реакции гидролиза аспирина при данном значении рН.
23. Рассчитать ΔН0, ΔS0, ΔG° процесса усвоения фруктозы в организме.
| Вещество | ΔН0, кДж/моль | ΔG°, кДж/моль | ΔS0, Дж/моль К |
| О2 | |||
| СО2 | -394 | -395 | |
| H2O | -286 | -237 | |
| С6Н12О6 | -1274 | -911 |
24. Вычислите стандартное значение энергии Гиббса гидратации сывороточного альбумина при 25°С, для которого ΔН°= - 7,03 кДж/моль, ΔS0 = -4,25 кДж/моль К.
25. Поверхностное натяжение водного раствора ПАВ с концентрацией с= 0,05 моль/л при 295К равно 6,34·10-2 Дж/м2. Вычислите адсорбцию этого вещества из раствора с концентрацией с= 0,01 моль л. Поверхностное натяжение воды при этой температуре равно 7,28·10-2 Дж/м2.
26. На нейтрализацию 30 мл раствора серной кислоты израсходовано 60 мл раствор NaOH с молярной концентрацией эквивалента, равной 0,15 моль/л. Рассчитайте С(1/Z H2SO4) в растворе.
27. При адсорбции уксусной кислоты из 0,5 л водного раствора 8 г активированного угля получены следующие данные: с0 = 0,5 моль/л, ср = 0,3 моль/л. Найдите адсорбцию.
28. Раствор уксусной кислоты объемом 60 мл с концентрацией 0,2 моль/л взбалтывался с адсорбентом массой 3 г. После достижения адсорбционного равновесия на титрование фильтра объемом 10 мл был затрачен титрант, объемом 18 мл с концентрацией NaОН 0,05 моль/л. Определите величину адсорбции уксусной кислоты.
29. Экспериментально установлено, что величина максимальной адсорбции на угле составляет 3,0∙10-2 моль/г. Величина α= 5,0∙10-3 моль/л, какая масса уксусной кислоты (адсорбата) адсорбировалось из раствора, в котором установилась равновесная концентрация 0,15 моль/л, если масса адсорбента 2г?
30. Коагуляция 30 мл гидрозоля гидроксида золота (III) наступила при добавлении к нему 7 мл 0,02 моль/л раствора сульфата натрия. Вычислите порог коагуляции и коагулирующую способность этого электролита.
31. Какие электронные эффекты проявляют функциональные группы в молекуле фенола? Напишите формулу, укажите электронные эффекты и характер совместного действия.
32. Укажите вид и знак электронных эффектов в следующих соединениях: анилин, бензойная кислота. Обозначьте эффекты графически.
33. Напишите формулу аминокислоты метионин в ионизированной форме: при рН=7 (в нейтральной среде); рН=2 (в кислой среде); рН=10 (в щелочной среде).
34. Приведите строение пептида, в состав которого входят аминокислоты: аспарагиновая кислота, пролин и фенилаланин.
35. Какие полисахариды называются восстанавливающими? Приведите формулу лактозы и укажите полуацетальный гидроксил.
36. Приведите строение D-фруктозы и D-глюкозы. Какой из этих моносахаридов обладает восстанавливающими свойствами.
37. Напишите формулы азотистых оснований: урацила и аденина.
38. Напишите структурные формулы следующих кислот: пальмитиновая кислота, линолевая кислота, олеиновая кислота.
39. Напишите формулы D, L-стереоизомеров глюкозы, используя формулы Фишера.
Приложение
Приложение 1. Аминокислоты.

Приложение 2. Образование трипептида.
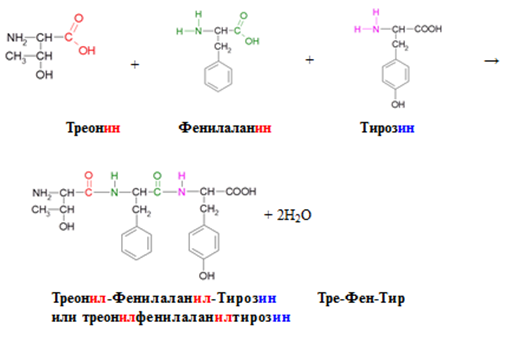
Приложение 3. Углеводы.


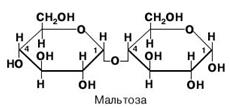
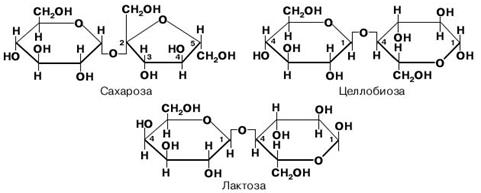
Приложение 4. Нуклеиновые кислоты.


Приложение 5.
 2017-11-01
2017-11-01 1984
1984








