Комплексы, в состав которых входит несколько центральных атомов одного или различных элементов, называют многоядерными. Возможность образования многоядерных комплексов определяется способностью некоторых лигандов связываться с двумя или тремя ионами металлов. Такие лиганды называются мостиковыми. Соответственно мостиковыми называются и комплексы. Принципиально возможны и одноатомные мостики, например:
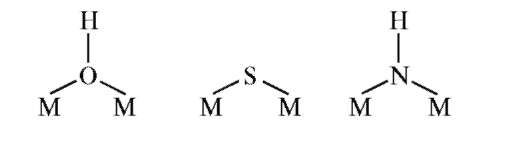
В них используются неподеленные электронные пары, принадлежащие одному и тому же атому. Роль мостиков могут исполнять многоатомные лиганды. В таких мостиках используются неподелен-ные электронные пары, принадлежащие разным атомам полиатомного лиганда.
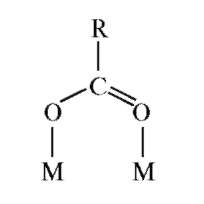
А.А. Гринберг и Ф.М. Филинов исследовали мостиковые соединения состава [Pt(NH3)2Br2]•[Pt(NH3)2Br4], в которых лиганд связывает комплексные соединения одного и того же металла, но в различных степенях окисления. Г. Таубе назвал их комплексами переноса электрона. Он исследовал реакции переноса электрона между центральными атомами различных металлов. Систематические исследования кинетики и механизма окислительно-восстановительных реакций привели к заключению, что перенос электрона между двумя комплексами про-
исходит через образующийся лигандный мостик. Обмен электроном между [Cr(H2O)6]2+ и [Co(NH3)5Cl]2+ происходит через образование промежуточного мостикового комплекса (рис. 7.5). Перенос электрона происходит через хлоридный мостиковый лиганд, заканчиваясь образованием комплексов [Co(NH3)5H2O]2+; [CrCl(H2O)5]2+.
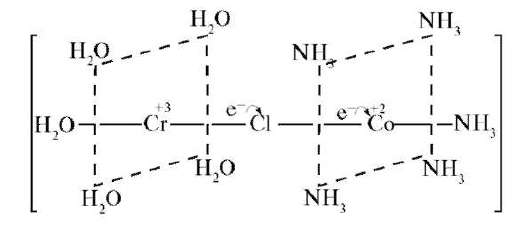
Рис. 7.5. Перенос электрона в промежуточном многоядерном комплексе
Большое разнообразие полиядерных комплексов получено благодаря использованию органических лигандов, содержащих несколько донорных групп. Условием их образования является такое расположение донорных групп в лиганде, которое не позволяет замыкаться хелатным циклам. Нередки случаи, когда лиганд имеет возможность замыкать хелатный цикл и одновременно выступать в роли мостико-вого.
Действующим началом переноса электрона являются переходные металлы, проявляющие несколько устойчивых степеней окисления. Это придает ионам титана, железа и меди идеальные свойства переносчиков электронов. Совокупность вариантов образования гетерова-лентных (ГВК) и гетероядерных комплексов (ГЯК) на основе Ti и Fe представлена на рис. 7.6.
Реакцию
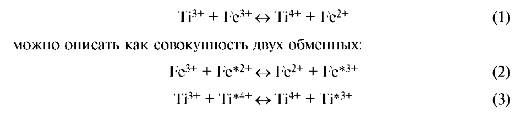
Реакция (1) называется перекрестной реакцией. В обменных реакциях интермедиатом будут гетеровалентные комплексы. Все теоретически возможные комплексы действительно образуются в растворе в тех или иных условиях, что доказано различными физико-химическими
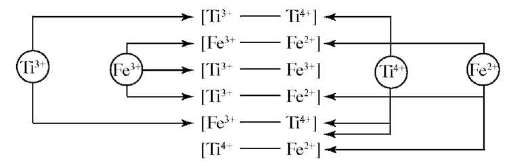
Рис. 7.6. Образование гетеровалентных комплексови гетероядерных комплексов, содержащих Ti и Fe
методами. Для осуществления переноса электронов реагенты должны находиться в близких по энергии состояниях. Это требование называется принципом Франка-Кондона. Перенос электрона может происходить между атомами одного переходного элемента, находящихся в разной степени окисления ГВК, или различных элементов ГЯК, природа металлоцен-тров которых различна. Эти соединения можно определить как комплексы переноса электронов. Они являются удобными переносчиками электронов и протонов в биологических системах. Присоединение и отдача электрона вызывает изменения лишь электронной конфигурации металла, не изменяя структуру органической составляющей комплекса. Все эти элементы имеют несколько устойчивых степеней окисления (Ti +3 и +4; Fe +2 и +3; Cu +1 и +2). По нашему мнению, этим системам предоставлена природой уникальная роль обеспечения обратимости биохимических процессов с минимальными энергетическими затратами. К обратимым реакциям относят реакции, имеющие термодинамические и термохимические константы от 10-3 до 103 и с небольшим значением ΔGo и Еo процессов. В данных условиях исходные вещества и продукты реакции могут находиться в соизмеримых концентрациях. При изменении их в некотором диапазоне легко можно достичь обратимости процесса, поэтому в биологических системах многие процессы носят колебательный (волновой) характер. Окислительно-восстановительные системы, имеющие в своем составе вышеуказанные пары, перекрывают широкий диапазон потенциалов, что позволяет им вступать во взаимодействия, сопровождающиеся умеренными изменениями Δ Go и Е°, со многими субстратами.
Вероятность образования ГВК и ГЯК значительно повышается, когда раствор содержит потенциально мостиковые лиганды, т.е. молекулы или ионы (аминокислот, гидроксикислот, комплексонов и др.), способные связать сразу два металлоцентра. Возможность делокализации электрона в ГВК способствует понижению полной энергии комплекса.
Более реально совокупность возможных вариантов образования ГВК и ГЯК, в которых природа металлоцентров разная, видна на рис. 7.6. Подробное описание образования ГВК и ГЯК и их роль в биохимических системах рассмотрены в работах А.Н. Глебова (1997). Окислительно-восстановительные пары должны структурно подстроиться друг к другу, тогда перенос становится возможным. Подбирая компоненты раствора, можно «удлинять» расстояние, на которое переносится электрон от восстановителя к окислителю. При согласованном перемещении частиц может происходить перенос электрона на большие расстояния по волновому механизму. В качестве «коридора» может быть гидратированная белковая цепочка и др. Высока вероятность переноса электрона на расстояние до 100А. Длину «коридора» можно увеличить добавками (ионами щелочных металлов, фоновыми электролитами). Это открывает большие возможности в области управления составом и свойствами ГВК и ГЯК. В растворах они играют роль своеобразного «черного ящика», наполненного электронами и протонами. В зависимости от обстоятельств он может отдавать их другим компонентам или пополнять свои «запасы». Обратимость реакций с их участием позволяет многократно участвовать в циклических процессах. Электроны переходят от одного металлического центра к другому, осциллируют между ними. Молекула комплекса остается несимметричной и может принимать участие в окислительно-восстановительных процессах. ГВК и ГЯК активно участвуют в колебательных процессах в биологических средах. Данный тип реакций называют колебательными реакциями. Они обнаружены в ферментативном катализе, синтезе белков и других биохимических процессах, сопутствующих биологическим явлениям. Сюда относятся периодические процессы клеточного метаболизма, волны активности в сердечной ткани, в ткани мозга и процессы, происходящие на уровне экологических систем. Важным этапом обмена веществ является отщепление водорода от питательных веществ. Атомы водорода переходят при этом в ионное состояние, а отделенные от них электроны вступают в дыхательную цепь и отдают свою энергию на образование АТФ. Как нами установлено, комплексонаты титана являются активными переносчиками не только электронов, но и протонов. Способность ионов титана выполнять свою роль в активном центре ферментов типа каталаз, пероксидаз и цитохромов определяется его высокой способностью к комплексообразованию, формированию геометрии координированного иона, образованию многоядерных ГВК и ГЯК различного состава и свойств в функции pH, концентрации переходного элемента Ti и органической составляющей комплекса, их мольного соотношения. Эта способность проявляется в повышении селективности комплекса
по отношению к субстратам, продуктам метаболических процессов, активацией связей в комплексе (ферменте) и субстрате посредством координации и изменения формы субстрата в соответствии со стериче-скими требованиями активного центра.
Электрохимические превращения в организме, связанные с переносом электронов, сопровождаются изменением степени окисления частиц и возникновением окислительно-восстановительного потенциала в растворе. Большая роль в этих превращениях принадлежит многоядерным комплексам ГВК и ГЯК. Они являются активными регуляторами свободнорадикальных процессов, системой утилизации активных форм кислорода, перекиси водорода, окислителей, радикалов и участвуют в окислении субстратов, а также в поддержании антиоокислительного гомеостаза, в защите организма от окислительного стресса. Их ферментативное действие на биосистемы аналогично ферментам (цитохро-мам, супероксиддисмутазе, каталазе, пероксидазе, глутатион-редуктазе, дегидрогеназам). Все это указывает на высокие антиоксидантные свойства комплексонатов переходных элементов.
 2017-11-01
2017-11-01 1021
1021







