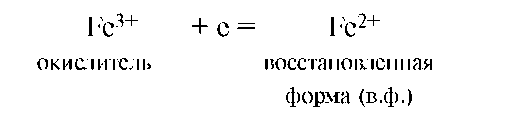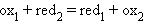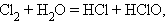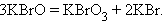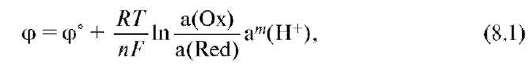Вопросы для изучения темы:
1. Комплексные соединения. Координационная теория Вернера. Строение комплексных соединений.
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ СТРОЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Ионы некоторых элементов способны присоединять к себе другие ионы или нейтральные молекулы (например, NH3), образуя более сложные комплексные ионы. При их связывании с ионами противоположного знака получаются различные комплексные соединения. Наиболее полно свойства и строение комплексных соединений объясняет координационная теория, предложенная в 1893 г. А. Вернером. При взаимодействии частиц наблюдается взаимная координация частиц, которую можно определить как процесс комплексообразования. Например, процесс гидратации ионов заканчивается образованием аквакомплексов. Реакции комплексообразования сопровождаются переносом электронных пар и приводят к образованию или разрушению соединений высшего порядка, так называемых комплексных (координационных) соединений. Особенностью комплексных соединений является наличие в них координационной связи, возникшей по донорно-акцепторному механизму:  Комплексными соединениями называются соединения, существующие как в кристаллическом состоянии, так и в растворе, особенностью которых является наличие центрального атома, окруженного лигандами. Комплексные соединения можно рассматривать как сложные соединения высшего порядка, состоящие из простых молекул, способных к самостоятельному существованию в растворе. Основные положения координационной теории. В молекуле любого комплексного соединения один из ионов, обычно положительно заряженный, занимает центральное место и называется комплексообразователем (центральным ионом). Вокруг него в непосредственной близости расположено (координировано) некоторое число противоположно заряженных ионов или нейтральных молекул, называемых лигандами и образующих внутреннюю координационную сферу. Остальные ионы находятся на более далеком расстоянии от центрального иона и составляют внешнюю координационную сферу. Комплексными соединениями называются соединения, существующие как в кристаллическом состоянии, так и в растворе, особенностью которых является наличие центрального атома, окруженного лигандами. Комплексные соединения можно рассматривать как сложные соединения высшего порядка, состоящие из простых молекул, способных к самостоятельному существованию в растворе. Основные положения координационной теории. В молекуле любого комплексного соединения один из ионов, обычно положительно заряженный, занимает центральное место и называется комплексообразователем (центральным ионом). Вокруг него в непосредственной близости расположено (координировано) некоторое число противоположно заряженных ионов или нейтральных молекул, называемых лигандами и образующих внутреннюю координационную сферу. Остальные ионы находятся на более далеком расстоянии от центрального иона и составляют внешнюю координационную сферу.  Количество лигандов, окружающих центральный ион, называется координационным числом. Внутренняя сфера комплекса в значительной степени сохраняет стабильность в растворе (ее границы в формуле показывают квадратными скобками). Ионы внешней сферы в растворе легко отщепляются. При взаимодействии солей PtCl4 и KСl образуется комплексное соединение: PtCl4 + 2 KCl → K2[PtCl6] (или PtCl4·2KCl) Здесь внутренняя сфера состоит из комплексообразователя Pt4+, лигандов Cl–, а внешняя сфера – из ионов K+. Координационное число (КЧ) равно 6. Диссоциация * такой соли происходит по уравнению: K2[PtCl6] → 2 K+ + [PtCl6]2– Для установления принадлежности ионов к внешней или внутренней сфере часто пользуются реакциями ионного обмена. Например, при взаимодействии 1 моля PtCl4·4NH3 c AgNO3 осаждаются 2 моля AgCl: PtCl4·4NH3 + 2 AgNO3 → PtCl2(NO3)2·4NH3 + 2 AgCl↓ Следовательно, два иона Cl– принадлежат к внешней, а два других – к внутренней сфере комплекса, и формула соли имеет вид: [PtCl2(NH3)4]Cl2. Анализируя координационные числа многих комплексных соединений, А. Вернер пришел к выводу, что степень окисления * центрального атома является основным фактором, влияющим на координационное число. Например, координационное число 6 встречается в комплексных соединениях Pt4+, Cr3+, Co3+, Fe3+, координационное число 4 – в комплексах Cu2+, Zn2+, Pd2+, Pt2+, координационное число 2 – в комплексах Ag+, Cu+. Координационное число не является неизменной величиной для данного комплексообразователя, а обусловлено также природой лиганда, в частности, его дентатностью. Лиганды, занимающие во внутренней сфере одно место, называются монодентатными. Существуют лиганды, занимающие во внутренней сфере два или несколько мест. Такие лиганды называются бидентатными или полидентатными. Количество лигандов, окружающих центральный ион, называется координационным числом. Внутренняя сфера комплекса в значительной степени сохраняет стабильность в растворе (ее границы в формуле показывают квадратными скобками). Ионы внешней сферы в растворе легко отщепляются. При взаимодействии солей PtCl4 и KСl образуется комплексное соединение: PtCl4 + 2 KCl → K2[PtCl6] (или PtCl4·2KCl) Здесь внутренняя сфера состоит из комплексообразователя Pt4+, лигандов Cl–, а внешняя сфера – из ионов K+. Координационное число (КЧ) равно 6. Диссоциация * такой соли происходит по уравнению: K2[PtCl6] → 2 K+ + [PtCl6]2– Для установления принадлежности ионов к внешней или внутренней сфере часто пользуются реакциями ионного обмена. Например, при взаимодействии 1 моля PtCl4·4NH3 c AgNO3 осаждаются 2 моля AgCl: PtCl4·4NH3 + 2 AgNO3 → PtCl2(NO3)2·4NH3 + 2 AgCl↓ Следовательно, два иона Cl– принадлежат к внешней, а два других – к внутренней сфере комплекса, и формула соли имеет вид: [PtCl2(NH3)4]Cl2. Анализируя координационные числа многих комплексных соединений, А. Вернер пришел к выводу, что степень окисления * центрального атома является основным фактором, влияющим на координационное число. Например, координационное число 6 встречается в комплексных соединениях Pt4+, Cr3+, Co3+, Fe3+, координационное число 4 – в комплексах Cu2+, Zn2+, Pd2+, Pt2+, координационное число 2 – в комплексах Ag+, Cu+. Координационное число не является неизменной величиной для данного комплексообразователя, а обусловлено также природой лиганда, в частности, его дентатностью. Лиганды, занимающие во внутренней сфере одно место, называются монодентатными. Существуют лиганды, занимающие во внутренней сфере два или несколько мест. Такие лиганды называются бидентатными или полидентатными. |
2. Классификация и номенклатура. Получение комплексных соединений.
КЛАССИФИКАЦИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Существует несколько систем классификации комплексных соединений, которые основываются на различных принципах. 1. По принадлежности комплексного соединения к определенному классу соединений: • комплексные кислоты H2[SiF6]; • комплексные основания [Ag(NH3)2]OH; • комплексные соли K4[Fe(CN)6]. 2. По природе лиганда: аквакомплексы, аммиакаты, ацидоком-плексы (в качестве лигандов выступают анионы различных кислот, K4[Fe(CN)6]; гидроксокомплексы (в качестве лигандов - гидроксиль-ные группы, K3[Al(OH)6]); комплексы с макроциклическими лиганда-ми, внутри которых размещается центральный атом. 3. По знаку заряда комплекса: катионные - комплексный катион в комплексном соединении [Co(NH3)6]Cl3; анионные - комплексный анион в комплексном соединении K[PF6]; нейтральные - заряд комплекса равен 0. Комплексное соединение внешней сферы не имеет, например [Pt(NH3)2Cl2]. Это формула противоопухолевого препарата. 4. По внутренней структуре комплекса: а) в зависимости от числа атомов комплексообразователя: моноядерные - в состав комплексной частицы входит один атом комплексообразователя, например [Co(NH3)6]Cl3; многоядерные - в составе комплексной частицы несколько атомов ком-плексообразователя - железопротеиновый комплекс: 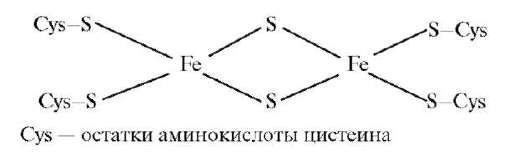 б) в зависимости от числа видов лигандов различают комплексы: однородные (однолигандные), содержащие один вид лиганда, например [Cu(NH3)4]2+, и разнородные (разнолигандные) - два вида лигандов или более, например Pt(NH3)2Cl2. В состав комплекса входят лиган-ды NH3 и Cl-. Для комплексных соединений, содержащих во внутренней сфере различные лиганды, характерна геометрическая изомерия, когда при одинаковом составе внутренней сферы лиганды в ней располагаются по-разному относительно друг друга. б) в зависимости от числа видов лигандов различают комплексы: однородные (однолигандные), содержащие один вид лиганда, например [Cu(NH3)4]2+, и разнородные (разнолигандные) - два вида лигандов или более, например Pt(NH3)2Cl2. В состав комплекса входят лиган-ды NH3 и Cl-. Для комплексных соединений, содержащих во внутренней сфере различные лиганды, характерна геометрическая изомерия, когда при одинаковом составе внутренней сферы лиганды в ней располагаются по-разному относительно друг друга.
Геометрические изомеры комплексных соединений отличаются не только по физическим и химическим свойствам, но и биологической активностью. Цис-изомер Pt(NH3)2Cl2 имеет ярко выраженную противоопухолевую активность, а транс-изомер - нет; в) в зависимости от дентатности лигандов, образующих моноядерные комплексы, можно выделить группы: • одноядерные комплексы с монодентатными лигандами, например [Co(NH3)6]3+; • одноядерные комплексы с полидентатными лигандами. Комплексные соединения с полидентатными лигандами называют хелатными соединениями; г) циклические и ациклические формы комплексных соединений. 5.3 НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ В химии под номенклатурой понимают систему правил составления названий соединений. Правила номенклатуры разрабатываются Международным союзом чистой и прикладной химии (IUPAC). Согласно номенклатуре комплексных соединений, название комплексного аниона начинают с указания состава внутренней сферы *. Во внутренней сфере прежде всего называют анионы, прибавляя к их названию окончание -о. Например: Cl– (хлоро-), CN– (циано-), OH– (гидроксо-) и т.д. Далее называют нейтральные лиганды *. При этом для аммиака используют название “аммин”, для воды – “аква”. Количество лигандов указывают греческими числительными: 2 – ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса. Затем называют комплексообразователь *, используя для него латинское название и окончание -ат, после чего римскими цифрами в скобках указывают степень окисления * комплексообразователя. После обозначения состава внутренней сферы называют внешнесферные катионы. Если комплексообразователь входит в состав катиона, то название внутренней сферы составляют так же, как в случае комплексного аниона, но используют русское название комплексообразователя и в скобках указывают степень его окисления. Примеры: K[Fe(NH3)2(CN)4] – тетрацианодиамминферрат (III) калия K4[Fe(CN)6] – гексацианоферрат (II) калия Na2[PtCl6] – гексахлороплатинат (IV) калия (NH4)2[Pt(OH)2Cl4] – тетрахлородигидроксоплатинат (IV) аммония [Pt(NH3)4Cl2]Cl2 – хлорид дихлоротетраамминплатины (IV) [Ag(NH3)2]Cl – хлорид диамминсеребра (I) Если комплексное соединение является неэлектролитом, т.е. не содержит ионов во внешней сфере, то степень окисления центрального атома не указывается, т.к. она однозначно определяется из условия электронейтральности комплекса. Например: [RhI3(NH3)3)] – трииодотриамминродий [Co(NO2)3(H2O)3] – тринитротриаквакобальт [Cu(CNS)2(NH3)2] – дироданодиамминмедь. 5.4 ПРИРОДА ХИМИЧЕСКОЙ СВЯЗИ В КОМПЛЕКСНЫХ СОЕДИНЕНИЯХ. ВТОРИЧНАЯ ДИССОЦИАЦИЯ КОМПЛЕКСОВ. КОНСТАНТА НЕСТОЙКОСТИ Согласно методу валентных связей *, образование комплексных соединений * осуществляется за счет донорно-акцепторного * взаимодействия между комплексообразователем * и лигандами *. Обычно центральный атом имеет свободные орбитали *, а лиганды имеют неподеленные электронные пары. В образовании такой координационной связи могут участвовать ns-, np-, nd- или (n–1)d- орбитали, где n – номер внешнего электронного слоя комплексообразователя. Координационное число * определяется гибридизацией * орбиталей центрального атома: Для примера рассмотрим образование координационных связей в ионе [Zn(NH3)4]2+. Здесь акцептором является ион Zn2+, имеющий вакантные орбитали на четвертом электронном слое и полностью занятый третий электронный слой. Четыре ковалентных связи * образуются с участием одной 4s- и трех 4p-орбиталей, которые перекрываются с орбиталями молекул аммиака (донор), содержащими неподеленные электронные пары: .Валентные орбитали цинка подвергаются sp3-гибридизации, поэтому лиганды (NH3) расположены в вершинах тетраэдра, в центре которого находится ион Zn2+. Донорно-акцепторная связь в комплексных соединениях является весьма прочной, однако наряду с диссоциацией, в которой отщепляются ионы внешней сферы, в очень незначительной степени разрушается также внутренняя сфера комплекса *: [Ag(NH3)2]Cl → [Ag(NH3)2]+ + Cl– (первичная диссоциация) [Ag(NH3)2]+.Ag+ + 2 NH3 (вторичная диссоциация Вторичная диссоциация подчиняется закону действия масс * и характеризуется соответствующей константой равновесия *, которая называется константой нестойкости комплексного иона: .
|
3. Внутрикомплексные соединения и их роль в биологических процессах. Полидентатные лиганды. Строение активного центра биологических комплексов: хлорофилла, гемоглобина, цианкобаламина, каталазы. Токсичность солей тяжелых металлов, взаимодействие их с комплексами биогенных металлов.
| Комплексные соединения - наиболее обширный и разнообразный класс соединений. В живых организмах присутствуют комплексные соединения биогенных металлов с белками, аминокислотами, порфи-ринами, нуклеиновыми кислотами, углеводами, макроциклическими соединениями. Важнейшие процессы жизнедеятельности протекают с участием комплексных соединений. Некоторые из них (гемоглобин, хлорофилл, гемоцианин, витамин В12 и др.) играют значительную роль в биохимических процессах. Многие лекарственные препараты содержат комплексы металлов. Например, инсулин (комплекс цинка), витамин В12 (комплекс кобальта), платинол (комплекс платины) и т.д. |
4. Антидоты: Унитиол (2,3-димеркаптопропансульфонат натрия), Трилон А (этилендиаминтетраацетат), Трилон Б (этилендиаминтетрауксусной кислоты динатриевая соль), Британский антилюизит (БАЛ) (2,3-димеркаптопропанол), Тетацин (этилендиаминтетрауксусной кислоты кальциевая соль), Пеницилламин (2-амино-3-меркапто-3-метилбутановая кислота), Ацизол (Цинка бисвинилимидазола диацетат).
Вещества, устраняющие последствия воздействия ядов на биологические структуры и инактивирующие яды посредством химических реакций, называют антидотами. Одним из первых антидотов, который применили в хелатотерапии, является британский антилюизит (БАЛ). В настоящее время применяют унитиол:  Этот препарат эффективно выводит из организма мышьяк, ртуть, хром и висмут. Наиболее широко используют при отравлении цинком, кадмием, свинцом и ртутью комплексоны и комплексонаты. Применение их основано на образовании более прочных комплексов с ионами металлов, чем комплексы этих же ионов с серосодержащими группами белков, аминокислот и углеводов. Для выведения свинца используют препараты на основе ЭДТА. Введение в организм в больших дозах препаратов опасно, так как они связывают ионы кальция, что приводит к нарушению многих функций. Поэтому применяют тетацин (СаNa2ЭДТА), который используют для выведения свинца, кадмия, ртути, иттрия, церия и других редкоземельных металлов и кобальта. Этот препарат эффективно выводит из организма мышьяк, ртуть, хром и висмут. Наиболее широко используют при отравлении цинком, кадмием, свинцом и ртутью комплексоны и комплексонаты. Применение их основано на образовании более прочных комплексов с ионами металлов, чем комплексы этих же ионов с серосодержащими группами белков, аминокислот и углеводов. Для выведения свинца используют препараты на основе ЭДТА. Введение в организм в больших дозах препаратов опасно, так как они связывают ионы кальция, что приводит к нарушению многих функций. Поэтому применяют тетацин (СаNa2ЭДТА), который используют для выведения свинца, кадмия, ртути, иттрия, церия и других редкоземельных металлов и кобальта.  Со времени первого лечебного использования тетацина в 1952 году этот препарат нашел широкое применение в клинике профессиональных заболеваний и продолжает оставаться незаменимым антидотом. Механизм действия тетацина весьма интересен. Ионы-токсиканты вытесняют координированный ион кальция из тетацина в связи с образованием более прочных связей с кислородом и ЭДТА. Ион кальция, в свою очередь, вытесняет два оставшихся иона натрия: Со времени первого лечебного использования тетацина в 1952 году этот препарат нашел широкое применение в клинике профессиональных заболеваний и продолжает оставаться незаменимым антидотом. Механизм действия тетацина весьма интересен. Ионы-токсиканты вытесняют координированный ион кальция из тетацина в связи с образованием более прочных связей с кислородом и ЭДТА. Ион кальция, в свою очередь, вытесняет два оставшихся иона натрия:  Тетацин вводят в организм в виде 5-10% раствора, основой которого является физиологический раствор. Так, уже через 1,5 ч после внутрибрюшинной инъекции в организме остается 15% введенной дозы тетацина, через 6 ч - 3%, а через 2 сут - только 0,5%. Эффективно и быстро действует препарат при применении ингаляционного метода введения тетацина. Он быстро всасывается и долго циркулирует в крови. Кроме того, тетацин используют при защите от газовой гангрены. Он ингибирует действие ионов цинка и кобальта, которые являются активаторами фермента лецитиназы, являющегося токсином газовой гангрены. Тетацин вводят в организм в виде 5-10% раствора, основой которого является физиологический раствор. Так, уже через 1,5 ч после внутрибрюшинной инъекции в организме остается 15% введенной дозы тетацина, через 6 ч - 3%, а через 2 сут - только 0,5%. Эффективно и быстро действует препарат при применении ингаляционного метода введения тетацина. Он быстро всасывается и долго циркулирует в крови. Кроме того, тетацин используют при защите от газовой гангрены. Он ингибирует действие ионов цинка и кобальта, которые являются активаторами фермента лецитиназы, являющегося токсином газовой гангрены. Связывание токсикантов тетацином в малотоксичный и более прочный хелатный комплекс, который не разрушается и легко выводится из организма через почки, обеспечивает детоксикацию и сбалансированное минеральное питание. Близким по структуре и составу к пре- паратам ЭДТА является натриево-кальциевая соль диэтилентриамин-пентауксусной кислоты (СаNa3ДТПА) - пентацин и натриевая соль диэтилентриаминпентафосфоновой кислоты (Na6ДТПФ) - тримефа-цин. Пентацин применяют преимущественно при отравлениях соединениями железа, кадмия и свинца, а также для удаления радионуклидов (технеция, плутония, урана).
Натриевая соль этилендиаминдиизопропилфосфоновой кислоты (СаNa2ЭДТФ) фосфицин успешно используется для выведения из организма ртути, свинца, берилия, марганца, актиноидов и других металлов. Комплексонаты весьма эффективны для удаления некоторых токсичных анионов. Например, этилендиаминтетраацетат кобальта (II), образующий смешанно-лигандный комплекс с CN-, может быть рекомендован в качестве антидота при отравлениях цианидами. Аналогичный принцип лежит в основе способов выведения токсичных органических веществ, в том числе пестицидов, содержащих функциональные группировки с донорными атомами, способными к взаимодействию с металлом комплексоната. Эффективным препаратом является сукцимер (димеркаптоянтарная кислота, димеркаптосукциновая кислота, хемет). Он прочно связывает практически все токсиканты (Hg, As, Pb, Cd), но выводит из организма ионы биогенных элементов (Cu, Fe, Zn, Co), поэтому почти не применяется. Фосфоросодержащие комплексонаты являются мощными ингибиторами кристаллообразования фосфатов и оксалатов кальция. В качестве антикальцифицирующего препарата при лечении мочекаменной болезни предложен ксидифон - калиево-натриевая соль ОЭДФ. Дифосфонаты, кроме того, в минимальных дозах увеличивают включение кальция в костную ткань, предупреждают патологический выход его из костей. ОЭДФ и другие дифосфонаты предотвращают различные виды остеопороза, включая почечную остеодистрофию, периоденталь- ную деструкцию, также деструкцию пересаженной кости у животных. Описан также антиатеросклеротический эффект ОЭДФ. В США предложен ряд дифосфонатов, в частности ОЭДФ, в качестве фармацевтических препаратов для лечения человека и животных, страдающих метастазированным раком костей. Регулируя проницаемость мембран, дифосфонаты способствуют транспортировке противоопухолевых лекарств в клетку, а значит, и эффективному лечению различных онкологических заболеваний. Одной из актуальных проблем современной медицины является задача экспрессной диагностики различных заболеваний. В этом аспекте несомненный интерес представляет новый класс препаратов, содержащих катионы, способные выполнять функции зонда - радиоактивных магниторелаксационных и флюоресцентных меток. В качестве основных компонентов радиофармацевтических препаратов используются радиоизотопы некоторых металлов. Хелатирование катионов этих изотопов комплексонами позволяет повысить их токсикологическую приемлемость для организма, облегчить их транспортировку и обеспечить в известных пределах избирательность концентрации в тех или иных органах. Приведенные примеры отнюдь не исчерпывают всего многообразия форм применения комплексонатов в медицине. Так, дикалиевая соль этилендиаминтетраацетата магния используется для регулирования содержания жидкости в тканях при патологии. ЭДТА применяется в составе антикоагулянтных суспензий, используемых при разделении плазмы крови, в качестве стабилизатора аденозинтрифосфата при определении глюкозы в крови, при осветлении и хранении контактных линз. При лечении ревматоидных заболеваний широко используют дифосфонаты. Они особенно эффективны в качестве противоартрит-ных средств в сочетании с противовоспалительными средствами.
|
5. Устойчивость комплексных соединений в растворах. Первичная и вторичная диссоциация комплексных соединений. Константа устойчивости и константа нестойкости комплексного иона и их взаимосвязь с устойчивостью комплекса.
| Наиболее устойчивые комплексные соединения имеют наименьшие константы нестойкости. С помощью этих величин можно предсказать течение реакций между комплексными соединениями. Реакция протекает в сторону продуктов с меньшими константами нестойкости. Например, для иона [Ag(NH3)2]+Kнест=6,8·10–8, а для иона аммония NH4+Kнест=5,4·10–10, поэтому под действием кислот аммиакат серебра разрушается с образованием ионов Ag+ и NH4+: [Ag(NH3)2]+ + 2 H+66 Первичной называется диссоциация, в которой отщепляются ионы внешней сферы. Внутренняя сфера при этом не разрушается. Вторичной называется диссоциация, при которой происходит разрушение внутренней сферы комплекса. .Ag+ + 2 NH4+ Для комплекса [Pt(NH3)4]2+Kнест=5·10–34, поэтому он не разрушается даже в концентрированной соляной кислоте. Иногда вместо константы нестойкости используют обратную ей величину, называемую константой устойчивости: Kуст=1/Kнест. Значения этих констант можно найти в справочнике. |
6. Комплексонометрическое титрование. Определение жесткости воды комплексонометрическим методом. Динатриевая соль этилендиаминтетрауксусной кислоты (ЭДТА) – Трилон Б. Металлиндикаторы – кислотный хромовый черный (эриохром черный Т).
31. Определение жесткости воды комплексонометрическим методом Жесткость воды выражают числом миллиграмм-эквивалентов кальция и магния в 1 л. Определение общей жесткости проводят путем комплексонометрического титрования раствором комплексона III в присутствии эриохром черного или хром темно-синего. Обычно определяют суммарное количество кальция и магния. При необходимости раздельного определения кальция и магния сначала определяют суммарное их количество. Затем в отдельной пробе осаждают кальций в виде оксалата кальция и оттитровывают ионы магния. Кальциевую жесткость определяют по разности. В присутствии некоторых примесей ход анализа изменяется. Ионы меди и цинка переводят в сульфиды, чтобы марганец не окислялся, прибавляют гидроксиламин. Присутствие в воде анионов не мешает определению общей жесткости. кальций количественно оттитровывают комплексоном III. Методика определения — Расчет: 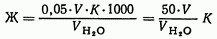 где Ж — жесткость воды, мг-экв/л; V — объем израсходованного раствора комплексона III, мл; К — поправочный коэффициент 0,05 н. раствора комплексона III; V взятой для исследования воды, мл. Пример. Для титрования взято 25мл воды, израсходовано 2,20 мл 0,05 н. раствора комплексона III. Поправочный коэффициент К этого раствора 0,9600. где Ж — жесткость воды, мг-экв/л; V — объем израсходованного раствора комплексона III, мл; К — поправочный коэффициент 0,05 н. раствора комплексона III; V взятой для исследования воды, мл. Пример. Для титрования взято 25мл воды, израсходовано 2,20 мл 0,05 н. раствора комплексона III. Поправочный коэффициент К этого раствора 0,9600. 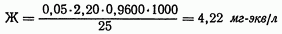 Для перевода мг-экв/л в градусы жесткости полученную величину жесткости в мг-экв/л умножают на 2,8: 4,22Х2,8= 11,8°. Объем отбираемой пробы воды зависит от содержания солей кальция и магния и колеблется от 10 до 100мл. Для перевода мг-экв/л в градусы жесткости полученную величину жесткости в мг-экв/л умножают на 2,8: 4,22Х2,8= 11,8°. Объем отбираемой пробы воды зависит от содержания солей кальция и магния и колеблется от 10 до 100мл.  Отмеряют требуемый объем анализируемой воды, добавляют 5мл аммиачного буферного раствора, 3—5 капель раствора эриохрома черного Т или другого подходящего комплексонометрического индикатора, имеющегося в лаборатории, доводят объем смеси до 100мл и титруют стандартным 0,05 н. раствором комплексона III до изменения красной окраски раствора в синюю. Отмеряют требуемый объем анализируемой воды, добавляют 5мл аммиачного буферного раствора, 3—5 капель раствора эриохрома черного Т или другого подходящего комплексонометрического индикатора, имеющегося в лаборатории, доводят объем смеси до 100мл и титруют стандартным 0,05 н. раствором комплексона III до изменения красной окраски раствора в синюю. |
7. Гетерогенные равновесия и процессы. Константа растворимости. Условия образования и растворения осадков. Реакции, лежащие в основе образования неорганического вещества костной ткани гидроксидфосфата кальция. Явление изоморфизма: замещение в гидроксидфосфате кальция гидроксид ионов на ионы фтора, ионов кальция на ионы стронция. Остеотропность металлов.
| ГЕТЕРОГЕННЫЕ РАВНОВЕСИЯ Термодинамическую систему, все свойства которой во всех точках одинаковы, либо плавно изменяются от точки к точке, называют гомогенной. Гомогенная система может состоять из нескольких веществ, называемых компонентами. Гомогенными системами являются, например, водные растворы хорошо растворимых солей (NaCl, KCl, Ca(NO3)2) и органических соединений (этилового спирта, уксусной кислоты). Термодинамическую систему, свойства которой от точки к точке изменяются скачкообразно, называют гетерогенной. Такая система состоит из нескольких гомогенных частей. Гомогенную часть гетеро-генной системы называют фазой. Каждая фаза характеризуется массой, геометрическими размерами, и, главное, наличием границы раздела, отделяющей ее от других фаз. Гетерогенными системами являются, например, жидкость-пар, твердый осадок-насыщенный раствор, твердое тело-газ. Равновесия, которые устанавливаются на границе раздела фаз, называют гетерогенными равновесиями. Произведение растворимости (ПР) Рассмотрим процессы, возникающие при взаимодействии твердого вещества KtnAnm ионного типа с водой. Под действием растворителя ионы Ktm+ и Аnn- будут переходить в жидкую фазу и одновременно, за счет электростатического притяжения, часть перешедших в раствор ионов вновь будет осаждаться на твердой фазе. Спустя некоторое время в системе установится равновесие, кинетическим условием которого является равенство скоростей процессов растворения и осаждения, а термодинамическим - постоянство свободной энергии Гиббса (DG = 0). Раствор, находящийся в равновесии с твердой фазой, называют насыщенным. В водных растворах растворенная часть вещества-электролита, в большинстве случаев, полностью диссоциирует на ионы. Поэтому в системе твердое вещество – насыщенный раствор устанавливается равновесие между осадком и ионами, образовавшимися при диссоциации растворенной части вещества: KtnAnm(тв.) ⇄ nKtm+ + mAnn- Применив к этому равновесию закон действующих масс, получим выражение для константы равновесия: . Таким образом: В насыщенном растворе малорастворимого сильного электролита при данной температуре произведениемолярных концентраций его ионов, возведенных в степени их стехиометрических коэффициентов, есть величина постоянная и называется константой или произведением растворимости. Произведение растворимости ПР (или) количественно харак-теризует растворимость данного вещества при данной температуре: Величина ПР зависит от природы электролита, растворителя и температуры. С ростом температуры ПР обычно увеличивается, так как при нагревании раствора для большинства твердых веществ характерно увеличение растворимости. Величина ПР малорастворимого сильного электролита связана с его растворимостью, которую в данном случае выражают как молярную концентрацию электролита в насыщенном растворе: n, m - стехиометрические коэффициенты т.е. число катионов и анионов. В некоторых случаях растворимость выражают в г/л. Пересчет можно выполнить при помощи соотношения: Условия образования и растворения осадка При любом произвольном соотношении компонентов «твердый осадок - раствор» система будет стремиться к состоянию равновесия. Этот процесс можно описать при помощи изотермы Вант-Гоффа: В ненасыщенном или пересыщенном растворе величина называется произведение концентраций ионов и обозначается. Из уравнения изотермы Вант-Гоффа видно, что если (пересыщенный раствор), то DG > 0 и, следовательно, процесс самопроизвольно протекает в обратном направлении, т.е. в сторону образования твердой фазы. В другом случае, если (ненасыщенный раствор), то DG < 0 и процесс самопроизвольно протекает в прямом направлении, т.е. в сторону растворения осадка. Таким образом, зная концентрации ионов в растворе, можно прогнозировать направление смещениягетерогенного равновесия: Отсюда следует, что для растворения осадка достаточно уменьшить концентрацию одного из ионов. Этого можно достичь, например, добавляя реагент, связывающий ион малорастворимого электролита в растворимое малодиссоциирующее соединение или газообразное вещество. Смещение гетерогенного равновесия 1. Влияние одноименного иона. Из постоянства величины ПР не следует постоянство концентраций отдельных ионов и концентрацию каждого из них можно варьировать в определенных пределах. При добавлении одноименного иона, например Аnn-, в системе установится равновесие, которое будет по-прежнему характеризоваться той же величиной, но другими равновесными концентрациями ионов Ktm+ и Аnn-. BaSO4 ⇄ Ba2+ + SO42- смещение равновесия Na2SO4 2Na+ + SO42- Видно, что введение в систему одноименного иона смещает равновесие в направлении образования осадка. Таким образом, при осаждении сульфатов в виде BaSO4 добавление Na2SO4 понижает растворимость сульфата бария и способствует более полному выведению ионов Ba2+ из раствора. 2. Влияние посторонних ионов. Введение в насыщенный раствор вещества-электролита, не содержащего одноименных ионов с осадком, напротив, повышает растворимость соединения (солевой эффект). Причиной солевого эффекта является усиление межионных взаимодействий, способст-вующих переходу ионов вещества из кристаллической решетки (твердой фазы) в раствор. Так, растворимость сульфата бария в растворе хлорида натрия - сильного электролита, не образующего одноименных ионов с осадком - выше, чем в чистой воде. 3. Влияние кислотности среды. В некоторых случаях малорастворимые соли слабых кислот растворяются в более сильных кислотах. Добавление сильной кислоты повышает концентрацию ионов H+, которые с анионами соли образуют малодиссоциированную слабую кислоту. При этом концентрация аниона понижается, и гетерогенное равновесие смещается в сторону растворения осадка. Так, малорастворимый в воде карбонат бария легко растворяется при добавлении соляной кислоты, поскольку из-за протекания реакции: 2H+ + CO32- ⇄ H2CO3 ⇄ СО2 + H2O в растворе снижается концентрация ионов СО32- и равновесие: BaCO3 ⇄ Ba2+ + CO32- смещается в сторону растворения осадка. Растворимость солей, образованных анионами слабых одноосновных кислот, можно вычислить по формуле: . Для малорастворимых солей, образованных слабыми двухосновными кислотами, справедливо уравнение: . Из этих уравнений можно сделать следующие выводы: Чем больше произведение растворимости соли и чем меньше константа диссоциации образующейся слабой кислоты, тем больше растворяющее действие прибавляемой кислоты на осадок. Чем слабее кислота, соответствующая аниону соли (т.е. чем меньше), тем меньшее подкисление раствора требуется для увеличения растворимости соли. Биологическая роль гетерогенных равновесий Важную роль в организме играют гетерогенные равновесия между ионами Са2+, РО43-, ОН- и костной тканью, основу которой составляет гидроксиапатит Са10(РО4)6(ОН)2. Для нормального функционирования организма вреден как недостаток кальция, так и его избыток. При недостатке ионов Са2+ возможно размягчение костной ткани, повышение хрупкости костей и другие негативные явления. При избытке ионов Са2+ в организме самопроизвольно происходит смещение гетерогенного равновесия в сторону образования осадка, что может сопровождаться окостенением скелета, артритом и другими физиологическими отклонениями. Распространенным заболеванием является кариес зубов. Эта патология также связана со смещением гетерогенного равновесия. Кариес зубов начинается с образования на поверхности зуба поврежденного участка эмали. Под действием кислот, вырабатываемых бактериями, происходит частичное растворение гидроксиапатита, который входит в состав зубной эмали: Са10(РО4)6(ОН)2 + 14Н+ 10Са2+ + 6Н2РО4- + 2Н2О. В качестве средства, корректирующего нарушение гетерогенного равновесия и повышающего сопротивляемость зубов к кариесу, используют фторид натрия NaF. Применение NaF способствует осаж-дению фторапатита, тем самым ускоряя процесс реминерализации (образование кристаллов): 10Ca2+ + 6PO43-+ 2F- Са10(РО4)6F2¯. Кроме того, фторид-ионы легко замещают гидроксид-ионы в гидроксиапатите, образуя менее растворимый (и более твердый) защитный слой фторапатита: Са10(РО4)6(ОН)2 + F- Са10(РО4)6F2¯ + 2ОH-. Следует отметить, что предельно допустимой концентрацией фторид-ионов в питьевой воде является 1 мг/л. Превышение этой концентрации может привести к другому заболеванию - фторозу. |
8. Механизм функционирования кальциевого буфера.
9. Реакции, лежащие в основе образования конкрементов: уратов, оксалатов, карбонатов. Применение хлорида кальция и сульфата магния в качестве антидотов.
10. Классификация и сущность методов осадительного титрования. Аргентометрия.
11. Электронная теория окислительно-восстановительных реакций (ОВР) (Л.В. Писаржевский).
В 1913 году Л.В. Писаржевский выступил с электронной теорией окислительно-восстановительных процессов, которая является в настоящее время общепринятой. Этот тип реакций осуществляется за счет перераспределения электронной плотности между атомами реагирующих веществ (переходом электронов), что проявляется в изменении степени окисления. Реакции, в результате которых изменяются степени окисления атомов, входящих в состав реагирующих веществ вследствие переноса электрона между ними, называются окислительно-восстановительными реакциями. Окислительно-восстановительный процесс состоит из 2 элементарных актов или полуреакций: окисления и восстановления. Окисление - это процесс потери (отдачи) электронов атомом, молекулой или ионом. При окислении степень окисления частиц повышается:  Частица, отдающая электроны, называется восстановителем. Продукт окисления восстановителя называется его окисленной формой: Частица, отдающая электроны, называется восстановителем. Продукт окисления восстановителя называется его окисленной формой:  Восстановитель со своей окисленной формой составляют одну пару окислительно-восстановительной системы (Sn2+/Sn4+). Мерой восстановительной способности того или иного элемента является потенциал ионизации. Чем меньше потенциал ионизации элемента, тем более сильным восстановителем он является, s-элементы и элементы в низшей и промежуточной степени окисления - сильные восстановители. Способность частицы отдавать электроны (донорная способность) определяет ее восстановительные свойства. Восстановление - это процесс присоединения электронов частицей. При восстановлении степень окисления понижается: Восстановитель со своей окисленной формой составляют одну пару окислительно-восстановительной системы (Sn2+/Sn4+). Мерой восстановительной способности того или иного элемента является потенциал ионизации. Чем меньше потенциал ионизации элемента, тем более сильным восстановителем он является, s-элементы и элементы в низшей и промежуточной степени окисления - сильные восстановители. Способность частицы отдавать электроны (донорная способность) определяет ее восстановительные свойства. Восстановление - это процесс присоединения электронов частицей. При восстановлении степень окисления понижается:  Частица (атомы, молекулы или ионы), присоединяющая электроны, называется окислителем. Продукт восстановления окислителя называется его восстановленной формой: Частица (атомы, молекулы или ионы), присоединяющая электроны, называется окислителем. Продукт восстановления окислителя называется его восстановленной формой:
Окислитель со своей восстановленной формой составляет другую пару (Fe3+/Fe2+) окислительно-восстановительной системы. Мерой окислительной способности частиц является сродство к электрону. Чем больше сродство к электрону, т.е. электроноакцепторная способность частицы, тем более сильным окислителем он является. Окисление всегда сопровождается восстановлением, и, наоборот, восстановление связано с окислением.
|
12. Окислительно-восстановительные свойства элементов и их соединений в зависимости от положения элемента в Периодической системе элементов и степени окисления элементов в соединениях.
13. Сопряженные пары окислитель-восстановитель. Окислительно-восстановительная двойственность.
Рассмотрим взаимодействие FeCl3 с SnCl2. Процесс состоит из двух полуреакций:  Окислительно-восстановительную реакцию можно представить в виде сочетания двух сопряженных пар. В ходе реакций окислитель превращается в сопряженный восстановитель (продукт восстановления), а восстановитель в сопряженный окислитель (продукт окисления). Их рассматривают как окислительно-восстановительные пары: Окислительно-восстановительную реакцию можно представить в виде сочетания двух сопряженных пар. В ходе реакций окислитель превращается в сопряженный восстановитель (продукт восстановления), а восстановитель в сопряженный окислитель (продукт окисления). Их рассматривают как окислительно-восстановительные пары: 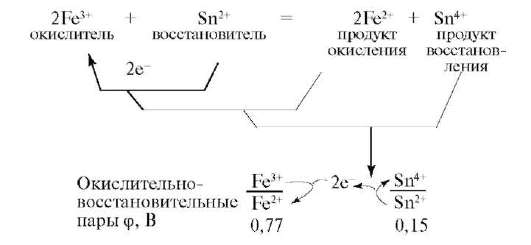 Поэтому окислительно-восстановительные реакции представляют единство двух противоположных процессов окисления и восстановления, которые в системах не могут существовать один без другого. Поэтому окислительно-восстановительные реакции представляют единство двух противоположных процессов окисления и восстановления, которые в системах не могут существовать один без другого. |
14. Типы окислительно-восстановительных реакций: межмолекулярные, внутримолекулярные, диспропорционирования. Составление окислительно-восстановительных реакций методом электронного и ионно-электронного баланса.
Все химические реакции, в которых электроны переходят от одного вещества или его части (восстановителя) к другому веществу или к другой части одного и того же вещества (окислителю), называются окислительно-восстановительными, или редокспроцессами. Любому веществу-окислителю (ox1) соответствует восстановленная форма (red1), а восстановителю (red2) – окисленная форма (ox2), вместе они образуют сопряженную окислительно-восстановительную пару (полуреакцию):
Сложение обеих полуреакций позволяет записать в общем виде окислительно-восстановительную реакцию:
Если передача электронов от восстановителя к окислителю происходит во всем объеме раствора, то энергия химического взаимодействия рассеивается в окружающую среду в виде тепла (Δ H < 0). В зависимости от того, находятся ли атомы, выполняющие в реакции функцию окислителя (акцептора электронов) и восстановителя (донора электронов) в одном или в различных веществах, все окислительно-восстановительные процессы можно разделить на три типа: межмолекулярные, внутримолекулярные и диспропорционирования.
В межмолекулярных (межатомных) реакциях окислительные функции выполняют одни вещества, а восстановительные – другие. Например, в реакции H2S + Cl2 = S + 2HCl электроны от восстановителя – молекулы сероводорода – переходят к окислителю – молекуле Cl2. В реакциях внутримолекулярного окисления-восстановления одна часть молекулы – окислитель, другая – восстановитель. Простейшими примерами могут служить реакции термического разложения вещества:
Реакции диспропорционирования (самоокисления-самовосстановления) протекают с одновременным уменьшением и увеличением степени окисления атомов одного и того же элемента. Они характерны для соединений или простых веществ, состоящих из промежуточных степеней окисления данного элемента:
|
15. Механизм возникновения электродного и редокс. Стандартные, реальные, формальные электродные и окислительно-восстановительные потенциалы (редокс-потенциалы). Уравнение Нернста-Петерса. Сравнительная сила окислителей и восстановителей.
| Окислительно-восстановительные потенциалы пары зависят от природы участников электродного процесса и соотношения равновесных концентраций окисленной и восстановленной форм участников электродного процесса в растворе, температуры раствора и описываются уравнением Нернста.Количественной характеристикой окислительно-восстановительной системы является редокс-потенциал, возникающий на границе раздела фаз платина - водный раствор. Величина потенциала в единицах СИ измеряется в вольтах (В) и рассчитывается по уравнению Нернста-Петерса:
где а(Oх) и a(Red) - активность окисленной и восстановленной форм соответственно; R - универсальная газовая постоянная; Т - термодинамическая температура, К; F - постоянная Фарадея (96 500 Кл/моль); n - число электронов, принимающих участие в элементарном редокс-процессе; а - активность ионов гидроксония; m - стехиометрический коэффициент перед ионом водорода в полуреакции. Величина φ° - стандартный редокс-потенциал, т.е. потенциал, измеренный при условиях а(Oх) = a(Red) = a(H+) = 1 и данной температуре. Стандартный потенциал системы 2Н+/Н2 принят равным 0 В. Стандартные потенциалы являются справочными величинами, табулируются при температуре 298К. Сильнокислая среда не характерна для биологических систем, поэтому для характеристики процессов, протекающих в живых системах, чаще используют формальный потенциал, определяемый при условии а(Oх) = a(Red), pH 7,4 и температуре 310К (физиологический уровень). При записи потенциала пара указывается в виде дроби, причем окислитель записывается в числителе, а восстановитель в знаменателе. Для 25 °С (298К) после подстановки постоянных величин (R = = 8,31 Дж/моль • град; F = 96 500 Кл/моль) уравнение Нернста принимает следующий вид:
где φ°- стандартный окислительно-восстановительный потенциал пары, В; со.фю и св.ф. - произведение равновесных концентраций окисленной и восстановленной форм соответственно; х и у - стехиометри-ческие коэффициенты в уравнении полуреакций. Электродный потенциал образуется на поверхности металлической пластины, погруженной в раствор ее соли, и зависит только от концентрации окисленной формы [Мn+], так как концентрация восстановленной формы не изменяется. Зависимость электродного потенциала от концентрации одноименного с ним иона определяется уравнением:
где [Мn+] - равновесная концентрация иона металла; n - число электронов, участвующих в полуреакции, и соответствует степени окисления иона металла. Редокс-системы делят на два типа: 1) в системе осуществляется только перенос электронов Fe3+ + ē = = Fe2+, Sn2+ - 2ē = Sn4+. Это изолированное окислительно-восстановительное равновесие; 2) системы, когда перенос электронов дополняется переносом протонов, т.е. наблюдается совмещенное равновесие разных типов: протолитическое (кислотно-основное) и окислительно-восстановительное с возможной конкуренцией двух частиц протонов и электронов. В био Для самопроизвольного протекания окислительно-восстановительной реакции необходимо, чтобы разность потенциалов сопряженных пар была величиной положительной, что следует из уравнения, т.е. пара, потенциал которой выше, может выполнять роль окислителя. Реакция идет до тех пор, пока потенциалы обеих пар не станут равными. Следовательно, чтобы ответить на вопрос, будет ли данный восстановитель окисляться данным окислителем или, наоборот, нужно знать ΔEo: ΔEo= φ°окисл. - φ°восстан. Реакция протекает в направлении, которое приводит к образованию более слабого окислителя и более слабого восстановителя. Таким образом, сравнивая потенциалы двух сопряженных пар, можно принципиально решить вопрос направления процесса. логических системах важные редокс-системы относятся к этому типу.
|
16. Стандартное изменение энергии Гиббса и Гельмгольца окислительно-восстановительной реакции. Прогнозирование направления протекания ОВ реакций по разности ОВ потенциалов. Влияние лигандного окружения центрального атома на величину редокс-потенциала. Влияние среды и внешних условий на направление окислительно-восстановительных реакций и характер образующихся продуктов.
| Сущность метода окислительно-восстановительного титрования Методы окислительно-восстановительного титрования, или редокс-методы, основаны на использовании реакций с переносом электронов — окислительно-восстановительных (ОВ) реакций. Другими словами, окислительно-восстановительное титрование, или редоксметрия, — это титрование, сопровождаемое переходом одного или большего числа электронов от иона-донора или молекулы (восстановителя) Red1 к акцептору (окислителю) Ох2: Red1 + Ох2 = Ox1 + Red2 Восстановленная форма одного вещества Red1, отдавая электроны, переходит в окисленную форму Ох1 того же вещества. Обе эти формы oбpaзуют oдну peдoкc-пapу Oxl|Redl. Окисленная форма Ох2 второго вещества, участвующего в ОВ реакции, принимая электроны, переходит в восстановленную форму Red2 того же вещества. Обе эти формы также образуют редокс-пару Ox2|Red2. В любой окислительно-восстановительной реакции участвуют, по крайней мере, две редокс-пары. Чем выше ОВ потенциал редокс-пары Ox2|Red2, окисленная форма которой играет роль окислителя в данной реакции, тем большее число восстановителей Red1 можно оттитровать и определить с помощью данного окислителя Ох2. Поэтому в редоксметрии в качестве титрантов чаще всего применяют окислители, стандартные ОВ потенциалы редокс-пар которых имеют как можно более высокие значения, например (при комнатной температуре): Се4+, Е °(Се4+|Cе3+) = 1,44 В; МnО4‑, Е °(МnО4‑, Н+|Mn2+) = 1,51 В, Cr2O72‑, Е °(Cr2О72‑, Н+|Cr3+) = 1,33 В и др. Напротив, если определяемые вещества — окислители Ох2, то для их титрования целесообразно применять восстановители, стандартный ОВ редокс-пар которых имеет по возможности минимальное значение, например Jֿ E °(J2|J⁻) = 0,54 В; S2O32‑, E° (S4O62‑|S2O32‑) = 0,09 B и т.д. Редокс-методы — важнейшие фармакопейные методы количественного анализа. Перманганатометрическое титрование или перманганатометрия-метод количественного определения веществ (восстановителей, реже-окислителей и соединений, не обладающих ОВ свойствами) с применением титранта-раствора перманганата калия. Метод - фармакопейный, включен во все известные Фармакопеи. Сущность метода. Перманганат калия - сильный окислитель, обладающий интенсивной фиолетово-малиновой окраской. В зависимости от кислотности титруемого раствора окислительные свойства перманганат-иона проявляются по-разному. В сильнокислой среде перманганат-ион восстанавливается до катионов марганца (ll), которые обладают очень слабой розоватой окраской (практически бесцветны):. В нейтральной среде перманганат-ион восстанавливается до диоксида марганца:,. В нейтральной среде эффективность перманганата калия как окислителя значиельно ниже, чем в сильнокислых растворах из-за небольшого ОВ потенциала редокс-парыи образующегося в результате ОВР бурого осадка диоксида марганца затрудняет фиксацию КТТ, осадок может адсорбировать определяемое вещество, что увеличивает ошибку анализа. В сильнощелочной среде перманганат-ион восстанавливается до манганат-иона:. Образующийся манганат-ион обладает зеленой окраской умеренной интенсивност, окрашивает раствор в зеленый цвет, что затрудняет обнаружение изменения окраски раствора и фиксацию КТТ. Манганат-ион вступаает в реакцию с водой с образованием бурого осадка диоксида марганца и перманганат-иона, что искажает результаты анализа:. Стандартный ОВ потенциал пары невелик,, Т.о. в щелчных средах перманганат калия как окислитель менее эффективен. Вывод: перманганатометрическое титрование целесообразно проводить в сильнокислых средах. йодометрия Йодометрические методы основаны на применении стандартного раствора тиосульфата натрия для титрования йода, выделившегося при взаимодействии определяемого окислителя с избытком иодида калия (при титровании по замещению) или оставшегося в избытке при медленном взаимодействии определяемого восстановителя с фиксированным объемом стандартного раствора йода (в случае обратного титрования). Основы метода Иодид-ион является восстановителем умеренной силы, его применяют для определения большого числа окислителей. Прямое титрование стандартным раствором KI не используют из-за трудностей индикации конечной точки титрования: прекращение образования свободного йода с помощью крахмала заметить нельзя. Поэтому для определения окислителей йодометрическим методом применяют способ титрования по замещению. Прямое титрование окислителей стандартным раствором тиосульфата натрия невозможно в связи с тем, что только I2 в нейтральной среде окисляет ион S2O32 - быстро в соответствии со стехиометрией реакции: I2 + 2S2O32-? 2I - + S4O62-. При титровании йода раствором тиосульфата наиболее благоприятна нейтральная либо слабокислая среда. Высокая кислотность раствора приводит к разложению тиосульфата: S2O32 - + 2H+? H2SO3 + S. В щелочной среде йодометрическое определение также не следует проводить из-за реакции диспропорционирования йода: I2 + 2OH -? IO - + I - +H2O. § |
17. Классификация и сущность методов окислительно-восстановительного титрования. Перманганатометрия, йодометрия.
Вопросы для самоконтроля знаний:
Дополните фразы:
1. Комплексные соединения – это соединения, существующие как в кристаллическом состоянии, так и в растворе, особенностью которых является наличие центрального атома, окруженного лигандами.
2. Комплексные соединения состоят из …комплексообразоват
3. еля и …лигандов….., образующих внутреннюю сферу, и внешней сферы.
4. С позиций теории валентных связей химическая связь между комплексообразователем и лигандом осуществляется за счет… донорно-акцепторного * взаимодействия между комплексообразователем * и лигандами ……….
5. Комплексообразователи – атомы или ионы, акцепторы…… электронных пар.
6. Роль комплексообразователя чаще выполняют …d….. и ….f.…. элементы.
7. Лиганды – это молекулы и ионы – …доноры……электронных пар.
8. Формулы лигандов, имеющих названия: аква – …..; аммин – …..; гидроксо – …..; циано – …….; тиосульфато – …….; нитро –..….; хлоро – …...; тиоцианато –..…..
Заряд внутренней сферы определяется как алгебраическая сумма … зарядов комплексообразователя и лигандов:
9. Внешняя сфера комплексного соединения – это ион противоположного знака, нейтрализующие …заряд ….. комплексного иона и связанные с ним ионогенной. связью.
10. Катионными являются комплексные соединения, внутренняя сфера которых имеет …+.…. заряд.
11. Анионными являются комплексные соединения, внутренняя сфера которых имеет ….отрицательный… заряд.
12. Математическое выражение Кн([Co(NH3)6]3+) имеет вид: …………
13. Чем меньше константа нестойкости, тем комплекс …более…. устойчив.
14. Дентатность – число связей, …………
15. Комплексообразователем в хлорофилле является ион ….…, в молекуле цианокобаламина – ион ….…., в гемоглобине – ион ….., в цитохромах – ион …..…, в каталазе – ион ….....
16. Лигандом в гемоглобине является ………...
17. Основные физиологические формы гемоглобина: ……..
18. Биологическая роль гемоглобина – транспорт ………
19. Хелатотерапия – ………. организма при помощи …….. на основе образования устойчивых ……….. соединений с ……………. – токсикантов.
20. Осадок образуется, если в растворе произведение концентраций ионов в степенях, равных их стехиометрическим коэффициентам …….. константы растворимости.
21. В ненасыщенном растворе Ks …. Пс.
22. Необходимое условие растворения осадка: Ks …. Пс.
23. Чем меньше константа растворимости труднорастворимого электролита, тем ……. его растворимость.
24. Если Ks(PbSO4) = 1,6∙10-8; Ks(SrSO4) = 3,2∙10-7; Ks(CaSO4) = 1,3∙10-4, то растворимость меньше у …….
25. Если Ks(ВаSO4) = 1,1∙10-10; Ks(SrSO4) = 3,2∙10-7; Ks(CaSO4) = 1,3∙10-4, то растворимость больше у ……
26. В насыщенный раствор карбоната серебра внесли кристаллы карбоната кальция. Растворимость Ag2CO3 при этом …….
27. Растворимость электролитов в последовательности: CaHPO4 → Ca4H(PO4)3 → Ca5(PO4)3OH постепенно понижается, поэтому более устойчивой формой фосфата кальция в организме является ………
28. В состав зубной эмали входит Ca5(PO4)3F. Использование фторсодержащих зубных паст приводит к …….. Пс, Кs ………….
29. К разрушению зубной ткани, в состав которой входит Ca5(PO4)3OH, будут приводить: ……. рН слюны, ……… концентрации Ca2+ в слюне.
30. Окислитель (Ox) – частица, ……………...
31. Восстановитель (Red) – частица, ………….
32. Восстановление – процесс, в ходе которого окислитель ……….. и переходит в сопряжённую ……… форму.
33. Окисление – процесс, в ходе которого восстановитель ………. и переходит в сопряжённую ……. форму.
34. Степень окисления – ………………...
35. Заполните таблицу:
| Элементы | Степень окисления |
| Щелочные металлы | +1 |
| Be, Mg, Ca, Sr, Ba, Zn, Cd | +2 |
| F | -1; |
| H | -1+1; |
| O | -2 |
| N, Р | -3,+2 |
| S | -2,+6 |
| С | -4,+4 |
| Cl, Br, I | -1 |
| Fe | +2,+3 |
| Mn | +2,+4,+7 |
| Cr | +2,+4,+6 |
| B, Al, Ga, In, Sc, Y, La и большинство лантанидов | +3 |
36. Окислительно-восстановительными называют процессы, сопровождающиеся …передачей электронов……….
37. Форма записи в общем виде сопряженной окислительно-восстановительной пары: ……..
38. Для реакции: 3Н2О2 + 2KMnО4 → 3О2 + MnО2 + 2Н2О + 2КОН сопряженные окислительно-восстановительные пары имеют вид: …………..
39. Стандартным называют потенциал, определенный в стандартных условиях: … в растворах при эффективной концентрации в 1 моль/кг и в газах при давлении в 1 атмосферу или 100 кПа (килопаскалей).……...
40. Потенциал водородного электрода при стандартных условиях принят равным ……0….
41. Отрицательное значение потенциала говорит о том, что восстановленная форма обладает менее……. выраженными восстановительными свойствами, чем Н2.
42. Положительное значение потенциала говорит о том, что окисленная форма обладает более……… выраженными окислительными свойствами, чем ионы водорода.
43. Уравнение Нернста-Петерса для расчета окислительно-восстановительного потенциала системы в реальных условиях: ………….
44. Формула для расчета формального окислительно-восстановительного потенциала системы: ………..
45. В биологических системах при Т = 310 К потенциал называют ………… потенциалом.
46. Энергию Гиббса окислительно-восстановительного процесса рассчитывают по формуле: ………
47. Стандартное значение электродвижущей силы (ЭДС) рассчитывается по формуле: ……….
48. Чем ……… разность стандартных окислительно-восстановительных потенциалов, тем редокс-процесс протекает в большей степени.
49. Наиболее сильный окислитель взаимодействует с ………... восстановителем с образованием наиболее ……… окислителя и восстановителя.
50. Чем ……… Кравновесия, тем процесс идет полнее.
51. Важнейшие коферментные формы ферментов класса оксидоредуктаз: ……………
52. Активные формы кислорода: ………….
53. Антиоксиданты — соединения, способные …….
54. Первую линию защиты от свободных радикалов составляют антиоксидантные ферменты, такие как ……..
55. Витамины антиоксиданты: ………..
56. Перманганатометрия относится к методам …….…… титрования.
Расчетные формулы:
φ0/ = φ0 (Ox/Red) + (RT/(n•F)) • ln ([Ox]•[Н+]m / [Red]) =
= φ0 (Ox/Red) + (0,059/n) • lg ([Ox]•[Н+]m / [Red]);
∆G = -n • F • Е0;
Е0 = φ0(Ox) - φ0(Red);
P = √Ks(AB);
P = m+n√(Ks(AmBn))/mm•nn;
ΔG = R • T • ln(Ks/Пс).
1. Определите степень окисления комплексообразователя в следующих комплексных соединениях: [Co(H2O)5Cl]SO4, K2[HgI4], [Zn(NH3)4]Cl2, [Pt(NH3)2Cl2I2], Na3[Al(OH)6], K2[SiF6], Na2[PtCl4], Mg[Pt(CN)6], [Ag(NH3)2]Cl, [Pt(NH3)6]Cl4. Назовите эти соединения. Какие из них катионные, анионные, не электролиты?
2. Запишите выражения для констант нестойкости следующих комплексных соединений: [Ni(NH3)4](OH)2, K2[HgI4], [Cr(H2O)3Cl3], K3[Fe(CN)6].
3. На титрование 50 мл воды с эриохромом черным Т было затрачено 4,58 мл раствора комплексона III с молярной концентрацией 0,05114 моль/л. Рассчитайте жесткость воды. Запишите химизм реакций, находящихся в основе количественного определения жесткости воды.
4. Отразите химизм взаимодействия унитиола (2,3-димеркаптопропансульфоната натрия) с солями токсичных металлов (ртуть, мышьяк).
5. Структурными формулами отразите строение активного центра биологических комплексов: хлорофилла, гемоглобина, цианкобаламина, каталазы.
6. Сформулируйте правило константы растворимости (произведения растворимости). Запишите выражения констант растворимости для сульфата кальция и карбоната кальция. Используя справочные данные, сравните их растворимость.
7. В растворе присутствуют в равных концентрациях сульфат- и карбонат-ионы. В каком порядке будут образовываться осадки сульфата и карбоната кальция при постепенном добавлении раствора, содержащего ионы кальция?
8. Сформулируйте условия растворения осадка. Приведите приемы и химические реакции, с помощью которых можно растворить осадок оксалата кальция (СаC2O4).
9. В какой последовательности будут выпадать осадки, если к раствору, содержащему в равных концентрациях ионы Ва2+, Sr2+ , Ca2+ , Pb2+ постепенно приливать раствор Na2SO4?
10. Определите степень окисления серы в следующих соединениях: SO2, H2S, Na2SO4, CS2, H2SO3, As2S3.
11. Какие из следующих реакций являются окислительно-восстановительными?
NH4NO3 → N2O + 2H2O
NH4Cl → NH3 +HCl
2CuI2 → 2CuI + I2
3I2 + 6KOH→ KIO3 + 5KI + 3H2O
12. Какие из приведенных процессов представляют собой окисление и какие – восстановление?
K → K+
Cl- → ClO3-
S → SO42-
2H+ → H2
MnO4- → Mn2+
13. Допишите уравнения, расставьте коэффициенты, используя метод электронного или ионно-электронного баланса:
Н2О2 + KMnO4 + H2SO4 → MnSO4 + O2 + …
Fe2O3 + NaNO3 + NaOH → Na2FeO4 + NaNO2 + …
14. Используя значения стандартных окислительно-восстановительных потенциалов и учитывая условия направленности процесса, определите, может ли хлор в стандартных условиях окислить: воду до пероксида водорода; бромид ион до брома; ион железа (II) до иона железа (III); ион марганца (II) до перманганат – иона?
15. Смешали 20 мл раствора хлорида железа (III) с концентрацией 0,05 моль/л и 25 мл раствора хлорида железа (II) с концентрацией 0,02 моль/л. Вычислите величину редокс-потенциала этой системы при Т = 298 К.
16. Рассчитайте массовую долю аскорбиновой кислоты (М(C6H8O6) = 176,13 г/моль) в процентах, если точную массу ее 0,1235 г растворили в воде и оттитровали раствором йода с молярной концентрацией эквивалента 0,098 моль/л. На титрование затрачено 14,0 мл раствора йода.
17. В процессе тканевого дыхания происходит перенос электронов от окисляемого субстрата на кислород с участием переносчиков, непосредственную функцию которых выполняют коферменты: убихинон, ФМН, цитохром с, цитохром b, цитохром аа3, цитохром с1. Исходя из значений окислительно-восстановительных потенциалов (таблица 7 приложения), составьте электронно-транспортную цепь последовательного переноса протонов и электронов от субстрата на акцептор.
1. Комплексные соединения. Координационная теория Вернера. Строение комплексных соединений. Классификация и номенклатура. Получение комплексных соединений. Пространственная изомерия комплексных соединений.
2. Внутрикомплексные соединения и их роль в биологических процессах. Полидентатные лиганды. Строение активного центра биологических комплексов: хлорофилла, гемоглобина, цианкобаламина, каталазы. Токсичность солей тяжелых металлов, взаимодействие их с комплексами биогенных металлов.
3. Антидоты: унитиол, комплексоны, британский антилюизит (БАЛ), тетацин, пенициламин.
4. Устойчивость комплексных соединений в рас
 2017-11-01
2017-11-01 5128
5128