Химическая кинетика или кинетика химических реакций — раздел физической химии, изучающий закономерности протекания химических реакций во времени, зависимости этих закономерностей от внешних условий, а также механизмы химических превращений.[1]
Предметом химической кинетики является изучение всех факторов, влияющих на скорость как суммарного процесса, так и всех промежуточных стадий.
Скорость химической реакции — величина всегда положительная, поэтому если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение умножается на −1.
Например, для реакции скорость можно выразить так:


A + B → C + D, {\displaystyle A+B\to C+D,}
v = ∂ C ∂ t = − ∂ A ∂ t. {\displaystyle v={\frac {\partial C}{\partial t}}=-{\frac {\partial A}{\partial t}}.} В 1865 году Н. Н. Бекетовым и в 1867 году К. М. Гульдбергом и П. Вааге был сформулирован закон действующих масс, согласно которому скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведённым в некоторые степени. Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы: природа реагирующих веществ, наличие катализатора, температура (правило Вант-Гоффа) и площадь поверхности раздела фаз.
Закон действующих масс в кинетической форме (основное уравнение кинетики) гласит, что скорость элементарной химической реакции пропорциональна произведению концентраций реагентов в степенях, равных стехиометрическим коэффициентам в уравнении реакции[1]. Это положение сформулировано в 1867 году норвежскими учёными К. Гульдбергом и П. Вааге. Для элементарной химической реакции:
ν 1 A 1 + ν 2 A 2 + ν 3 A 3 → B {\displaystyle \nu _{1}\mathrm {A} _{1}+\nu _{2}\mathrm {A} _{2}+\nu _{3}\mathrm {A} _{3}\rightarrow \mathrm {B} } 
закон действующих масс может быть записан в виде кинетического уравнения вида:
v = k C A 1 ν 1 C A 2 ν 2 C A 3 ν 3 {\displaystyle v=kC_{A_{1}}^{\nu _{1}}C_{A_{2}}^{\nu _{2}}C_{A_{3}}^{\nu _{3}}} 
где v {\displaystyle v} — скорость химической реакции, k {\displaystyle k} — константа скорости реакции.
Для сложных реакций в общем виде это соотношение не выполняется. Тем не менее, многие сложные реакции условно можно рассматривать как ряд последовательных элементарных стадий с неустойчивыми промежуточными продуктами, формально эквивалентный переходу из начального состояния в конечное в «один шаг». Такие реакции называют формально простыми [2]. Для формально простых реакций кинетическое уравнение может быть получено в виде:
v = k C A 1 n 1 C A 2 n 2 C A 3 n 3 {\displaystyle v=kC_{A_{1}}^{n_{1}}C_{A_{2}}^{n_{2}}C_{A_{3}}^{n_{3}}} 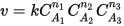
(для трех исходных веществ, аналогично приведённому выше уравнению). Здесь  n 1 {\displaystyle n_{1}}, n 2 {\displaystyle n_{2}}, n 3 {\displaystyle n_{3}} — порядок реакции по веществам A 1 {\displaystyle A_{1}}, A 2 {\displaystyle A_{2}}, A 3 {\displaystyle A_{3}} соответственно, а сумма n = n 1 + n 2 + n 3 {\displaystyle n=n_{1}+n_{2}+n_{3}} — общий (или суммарный) порядок реакции. n 1 {\displaystyle n_{1}}, n 2 {\displaystyle n_{2}}, n 3 {\displaystyle n_{3}} могут быть не равны стехиометрическим коэффициентам и не обязательно целочисленные. n {\displaystyle n} при определённых условиях может быть равно и нулю.
n 1 {\displaystyle n_{1}}, n 2 {\displaystyle n_{2}}, n 3 {\displaystyle n_{3}} — порядок реакции по веществам A 1 {\displaystyle A_{1}}, A 2 {\displaystyle A_{2}}, A 3 {\displaystyle A_{3}} соответственно, а сумма n = n 1 + n 2 + n 3 {\displaystyle n=n_{1}+n_{2}+n_{3}} — общий (или суммарный) порядок реакции. n 1 {\displaystyle n_{1}}, n 2 {\displaystyle n_{2}}, n 3 {\displaystyle n_{3}} могут быть не равны стехиометрическим коэффициентам и не обязательно целочисленные. n {\displaystyle n} при определённых условиях может быть равно и нулю.
 2017-11-01
2017-11-01 923
923








