Основными средами, имеющими значение в аналитической практике являются: хлоридные, сульфатные, аммиачные, нитратные, нитритные.
Серная кислота
В серной кислоте растворяется только серебро.
 2Ag + 2H2SO4 Ag2SO4 + SO2 + 2H2O;
2Ag + 2H2SO4 Ag2SO4 + SO2 + 2H2O;
 2Ag + H2SO4 + 1/2O2 Ag2SO4 + H2O;
2Ag + H2SO4 + 1/2O2 Ag2SO4 + H2O;
 Pd + H2SO4 PdSO4 + H2O + SO3.
Pd + H2SO4 PdSO4 + H2O + SO3.
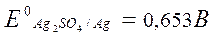 |
Ag2SO4 обладает органической растворимостью в воде:
- 13,6 г/л (900С);
- 8 г/л (200С).
При повышенной температуре или электрохимическом анодном окислении H2SO4 переходит в надсерную кислоту H2S2O8 :

 2H2S6+O4 H2 S27+O8 + H2
2H2S6+O4 H2 S27+O8 + H2
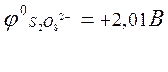 |
Образующийся персульфат – ион обладает высоким окислительным потенциалом:
Образующиеся сульфаты имеют сложный характер. Они являются многоядерными, акватированными комплексными соединениями:
[ Ptk (H2O)n (OH)m (SO4)x ]y
Использование свойств сульфатных соединений положены в основу технологии аффинажа серебра и переработки платиносодержащих шламов Норильского ГМК.
 2014-01-25
2014-01-25 748
748








