Математические выражения, описывающие скорости химических реакций, называются кинетическими.
Пусть идет реакция А + В → продукты реакции.
Чтобы молекулы прореагировали друг с другом, они должны войти в контакт, столкнуться. Рассмотрением столкновений молекул при реакциях занимается теория столкновений, которая позволяет разобраться в механизме протекания химических реакций. В соответствии с теорией столкновений скорость протекания реакций определяется двумя факторами: 1) числом столкновений между частицами реагентов (ионами, атомами или молекулами) в единицу времени; 2) долей столкновений, которые эффективно приводят к химическому взаимодействию. Роль первого фактора довольно очевидна: чем больше концентрация реагентов, тем больше вероятность столкновений между реагирующими молекулами. Но не все столкновения приводят к образованию продуктов. Доля эффективных столкновений определяется природой реагентов и температурой процесса. Поскольку скорость реакции определяется числом возможных столкновений между молекулами А и В, то можно записать кинетическое уравнение
υ = k∙ [А]∙ [B],
где [А], [В] - молярные концентрации веществ А и В соответственно; k - константа скорости реакции,важная величина, зависящая от природы реагирующих. Константа скорости реакции - это скорость химической реакции при концентрации реагирующих веществ, равных единице, т.е. [А] = [В] = 1 моль/дм3. Она не зависит от концентрации реагирующих веществ и для данной реакции при неизменной температуре - величина постоянная. Константа скорости реакции зависит от температуры и катализатора.
В общем случае для реакции, описываемой уравнением
аА + bВ + сС → продукты реакции,
выражение для скорости реакции имеет вид
υ = k∙ [А]а∙[В]b∙[С]С
Таким образом, скорость реакции пропорциональна произведению молярных концентраций реагентов в степени равной стехиометрическим коэффициентам в уравнении реакции. Это утверждение высказаноК. Гульдбергом и П. Вааге в 1867 г. и называется законом действия масс, или законом Гульдберга и Вааге.
В отношении кинетики химические реакции разделяются или по признаку молекулярности реакции или по признаку порядка. Порядок реакции определяется по более формальному признаку, чем молекулярность, - по виду уравнения, выражающего зависимость скорости реакции от концентрации реагирующих веществ. Молекулярность реакции всегда однозначно определяет её порядок, но значение порядка не даёт возможности судить о молекулярности реакции, если реакция протекает по сложному механизму. По этой причине различают формальный и кинетический порядки реакции.
Формальный порядок (n) равен сумме показателей степеней концентраций в уравнении, выражающем зависимость скорости реакции от концентрации реагентов. Для реакции вида
аА + вВ→....,
скорость реакции равна υ = k[А]а•[B]b, формальный порядок равен n = а + b.
Кинетический порядок является исключительно экспериментальной величиной. Различают парциальный кинетический порядок и общий кинетический порядок реакции.
Парциальный порядок - это порядок по каждому реагенту реакции в отдельности, он может быть целым, дробным или равным нулю. Когда порядок равен нулю, то скорость реакции остается постоянной при изменении концентрации данного реагента. Например, коррозия железа на воздухе протекает по уравнению кинетики нулевого порядка, так как концентрация кислорода практически остается постоянной
kо = 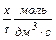 .
.
Поскольку реакция идет только на поверхности раздела фаз и плёнка оксида железа не препятствует диффузии кислорода, концентрация железа постоянна. Дробный парциальный порядок свидетельствует о сложном механизме реакции, протекающей в несколько стадий. При несоизмеримости скоростей отдельных стадий порядок определяется самой медленной стадией процесса. Общий кинетический порядок равен сумме парциальных порядков.
В отличие от кинетического порядка формальный порядок не дает информации о механизме протекания реакции, но его несовпадение с кинетическим порядком свидетельствует о сложном механизме. Одним из способов подтверждения порядка реакции является постоянство значений константы скорости реакций в ходе кинетического эксперимента.
 2014-01-31
2014-01-31 943
943








