| Формула | Название | t пл, °C | t кип, °C | Степень окисления | Цвет | Активность |
| N2O | Оксид азота (I) | - 90,91 | - 88,56 | + 1 | Бесцветный | Неактивный |
| NO | Оксид азота (II) | - 163,6 | - 151,73 | +2 | Газообразный – бесцветный, жидкий и твёр-дый – голубой | Умеренно активный |
| N2O3 | Азотистый ангидрид | - 102 | 3,5 | +3 | Красно-бурый газ; в твёрдом состоянии – синий | Сильно диссоциирован в газовой фазе |
| NO2 | Диоксид азота | - 11,25 | 21,10 | +4 | Коричневый | Довольно активен |
| N2O4 | Диоксид азота (димер) | Известно 2 изомера | +4 | Бесцветный | Димер, в газовой фазе и жидком состоя-нии частично диссоциирован до NO2 | |
| N2O5 | Азотный ангидрид | +5 | Бесцветный | В газовой фазе неустойчив, в твердом это NO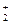 NO NO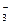
|
NH4NO3 = N2O + 2H2O, (64)
N2 + O2 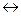 2NO – 180, 9 кДж (65)
2NO – 180, 9 кДж (65)
2NO + O2 = 2NO2 (66)
3Cu + 8HNO3 (разб.) = 3Cu(NO3)2 + 2NO + 4H2O (67)
3KNO2 + KNO3 + Cr2O3 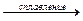 2K2CrO4 + 4NO (68)
2K2CrO4 + 4NO (68)
4NH3 + 5O2 = 4NO + 6H2O (69)
N ××××××× O
½ ½ (70)
O ××××××× N
SO2 + 2NO = N2O + SO3 (71)
2NO2 (бурый) 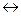 N2O4 (бесцв.) (72)
N2O4 (бесцв.) (72)
n M ® M n (73)
2NO + O2 = 2NO2 + 113 кДж, (74)
2Pb(NO3)2 = 2PbO + 4NO2 + O2 (75)
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O (76)
CH3 – H + ×NO2 = 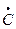 H3 + HONO (77)
H3 + HONO (77)
N2O4 + 2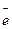 + 2H+ = 2HNO2 (78)
+ 2H+ = 2HNO2 (78)
2NO2 + H2O = HNO2 + HNO3 (79)
N2O3 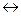 NO + NO2 (80)
NO + NO2 (80)
As2O3 + 2HNO3 = 2HAsO3 + NO + NO2 (81)
N2 + O2 ® 2NO (82)
2NO + O2 ® N2O3 (83)
N2O3 + H2O = 2HNO2 (84)
N2O3 + 2NaOH = 2NaNO2 + H2O (85)
2N2O5 = 4NO2 + O2 (86)
4HNO3 + P4O10 = (HPO3)4 + 2N2O5 (87)
2AgNO3(к) + Cl2 + N2O5 + 2AgCl + 1/2O2 (88)
N2O4(ж) + O3 = N2O5(ж) + O2 (89)
N2O5 + H2S = N2 + H2SO4 + 1/2O2 (90)
N2O5 + SO2 = N2 + SO3 + 2O2 (91)
H3NO4 + H2O Û H3O+ + H2NO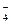 (92)
(92)
2HNO3 = 2NO2 + 1/2O2 + H2O (93)
2HNO3 + 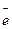 = NO2 + NO
= NO2 + NO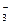 + H2O (94)
+ H2O (94)
NO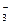 + 4H+ + 3
+ 4H+ + 3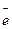 = NO + 2H2O (95)
= NO + 2H2O (95)
NO2 + 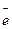 = NO
= NO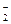 (96)
(96)
NO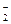 + H+ Û HNO2 (97)
+ H+ Û HNO2 (97)
HNO2 + HNO3 = 2NO2 + H2O (98)
Au + HNO3 + 4HCl = H[AuCl4] (99)
3Pt + 4HNO3 + 18HCl = 3H2[PtCl6] + 4NO + 8H2O (100)
4NH3 + 5O2 = 4NO + 6H2O (101)
2NO + O2 = 2NO2 (102)
3NO2 + H2O Û 2HNO3 + NO (103)
NO + NO2 + H2O Û 2HNO2, (104)
3HNO2 Û HNO3 + 2NO + 2H2O (105)
2N2O4 + 2H2O + O2 = 4HNO3 (106)
KNO3 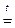 KNO2 + 1/2O2 (107)
KNO2 + 1/2O2 (107)
2KNO2 = K2O + N2 + 3/2O2 (108)
2Pb(NO3)2 = 2PbO + 4NO2 + O2 (109)
2AgNO3 = Ag2O + 2NO2 + O2 (110)
NH4NO3 (г) = NH3(г) + HNO3(г) (111)
NH4NO3(ж) 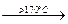 N2O + 2H2O (112)
N2O + 2H2O (112)
8NH4NO3(ж) 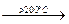 5N2 + 4NO + 2NO2 + 16H2O (113)
5N2 + 4NO + 2NO2 + 16H2O (113)
2N2H5NO3 = 3N2 + 1/2O2 + 5H2O (114)
Mn + 3KNO3(ж) +2KOH(ж) 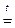 K2MnO4 + 3KNO2+H2O (115)
K2MnO4 + 3KNO2+H2O (115)
3HNO2 = HNO3 + 2NO + H2O (116)
NO + NO2 + H2O Û 2HNO2 (117)
HNO2 + H2O Û H3O+ + NO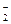 ; Ka = 5,1×10-4 (25°С) (118)
; Ka = 5,1×10-4 (25°С) (118)
Ba(NO2)2 + H2SO4 = 2HNO2 + BaSO4 (119)
H
\
O ¾ N Û O ¾ N (120)
\\ / \\
 2014-01-31
2014-01-31 711
711








