ЧЕЛНОЧНЫЕ МЕХАНИЗМЫ ПЕРЕНОСА ВОДОРОДА
Никотинамидные дегидрогеназы находятся не только в матриксе митохондрий, но и в цитозоле. Митохондриальная мембрана непроницаема для НАД, поэтому НАДН2, который образуется в цитозоле, может передать свой водород в митохондрию только с помощью специальных субстратных ЧЕЛНОЧНЫХ МЕХАНИЗМОВ. В митохондрию из цитозоля передается не сам НАДН2, а только водород, отнятый от него. Переносимый водород включается в молекулу вещества-челнока, способного проникать через митохондриальную мембрану. В митохондрии вещество-челнок отдает водород на митохондриальный НАД или ФАД и возвращается обратно в цитозоль.
В клетках организма человека существуют 2 типа челночных механизмов.
1. МАЛАТ-АСПАРТАТНЫЙ челнок (наиболее универсален для клеток организма). С высокой скоростью работает в миокарде, почечной ткани, печени.
В этой транспортной системе водород от цитоплазматического НАД передается на митохондриальный НАД(!), поэтому в митохондриях образуется 3 молекулы АТФ и не происходит потери энергии при переносе водорода. Для ткани печени малат-аспартатная система особенно важна, так как из митохондрии выводится Ацетил-КоА (в виде цитрата), а водород попадает в митохондрию (в составе малата).
Таким образом, происходит не только челночный транспорт водорода от цитоплазматического НАД к митохондриальному, а и обратный транспорт Ацетил-КоА из митохондрий в цитоплазму в виде цитрата. В цитоплазме Ацетил-КоА может быть использован для синтеза жирных кислот.
ЩУК может вернуться в цитоплазму и другим способом: она может вступить в реакцию трансаминирования с глутаминовой кислотой (СМОТРИТЕ РИСУНОК)
2. ГЛИЦЕРОФОСФАТНЫЙ челнок (встречается реже).
В этой транспортной системе водород от цитоплазматического НАД передается на митохондриальный ФАД(!), и в митохондриях образуется 2 молекулы АТФ вместо 3-х - происходит потеря энергии при переносе водорода.
В клетке существует не только челночный транспорт водорода от цитоплазматического НАД к митохондриальному. Происходит и обратный транспорт Ацетил-КоА из митохондрий в цитоплазму в виде цитрата. В цитоплазме Ацетил-КоА может быть использован для синтеза жирных кислот.
| Формула | Название кислоты R-COOH | Название остатка RCOO- | |
| систематическое | тривиальное | ||
| HCOOH | метановая | муравьиная | формиат |
| CH3COOH | этановая | уксусная | ацетат |
| C2H5COOH | пропановая | пропионовая | пропионат |
| C3H7COOH | бутановая | масляная | бутират |
| C4H9COOH | пентановая | валерьяновая | валерат |
| C5H11COOH | гексановая | капроновая | капрат |
| C15H31COOH | гексадекановая | пальмитиновая | пальмитат |
| C17H35COOH | октадекановая | стеариновая | стеарат |
| C6H5COOH | бензолкарбоновая | бензойная | бензоат |
| CH2=СH-COOH | пропеновая | акриловая | акрилат |
Название группы RCOO- (карбоксилат) входит в названия солей и сложных эфиров карбоновых кислот.
Для многоосновных кислот применяют суффиксы -диовая, -триовая и т.д.
Например:
· HOOC-COOH - этандиовая (щавелевая) кислота;
· HOOC-CH2-COOH - пропандиовая (малоновая) кислота.
Если атом углерода карбоксильной группы не входит в состав главной углеродной цепи (например, цикла), название кислоты строят из названия этой структуры, суффикса -карбоновая и слова кислота. Так, систематическое название бензойной кислоты C6H5-COOH - бензолкарбоновая кислота.
· Cтруктурная изомерия
- изомерия скелета в углеводородном радикале (начиная с C4).
- межклассовая изомерия, начиная с C2.
Например, формуле C2H4O2 соответствуют 4 изомера, относящиеся к различным классам органических соединений.
· Пространственная изомерия
- Возможна цис-транс изомерия в случае непредельных карбоновых кислот. Пример:
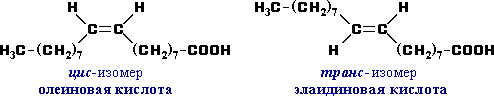
- Оптическую изомерию проявляют карбоновые кислоты, в молекулах которых присутствует асимметрический атом углерода (sp3-атом, связанный с 4-мя различными заместителями).
Например, 2-метилбутановая кислота C2H5CH(CH3)COOH существует в виде двух оптических изомеров.
Карбоксильная группа сочетает в себе две функциональные группы – карбонил и гидроксил, взаимно влияющие друг на друга. Это влияние передается по системе сопряжения sp 2-атомов O–C–O.
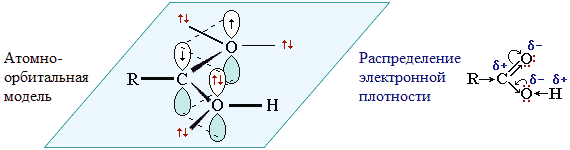
Электронное строение группы –СООН придает карбоновым кислотам характерные химические и физические свойства.
1. Смещение электронной плотности к карбонильному атому кислорода вызывает дополнительную (по сравнению со спиртами и фенолами) поляризацию связи О–Н, что определяет подвижность водородного атома (кислотные свойства).
В водном растворе карбоновые кислоты диссоциируют на ионы:
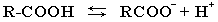
Однако карбоновые кислоты в целом – слабые кислоты: в водных растворах их соли сильно гидролизованы.
2. Пониженная электронная плотность (δ+) на атоме углерода в карбоксильной группе обусловливает возможность реакций нуклеофильного замещения группы -ОН.
3. Группа -СООН за счет положительного заряда на атоме углерода снижает электронную плотность на связанном с ней углеводородном радикале, т.е. является по отношению к нему электроноакцепторным заместителем. В случае предельных кислот карбоксильная группа проявляет -I -эффект, а в непредельных (например, CH2=CH-COOH) и ароматических (С6Н5-СООН) – -I и -М -эффекты.
4. Карбоксильная группа, являясь электроноакцептором, вызывает дополнительную поляризацию связи С–Н в соседнем (α-) положении и увеличивает подвижность α-водородного атома в реакциях замещения по углеводородному радикалу.
См. также "Реакционные центры в молекулах карбоновых кислот".
Атомы водорода и кислорода в карбоксильной группе -СООН способны к образованию межмолекулярных водородных связей, что во многом определяет физические свойства карбоновых кислот.
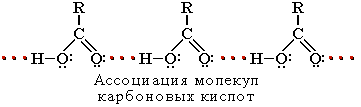
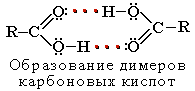
Вследствие ассоциации молекул карбоновые кислоты имеют высокие температуры кипения и плавления. При нормальных условиях они существуют в жидком или твёрдом состоянии.
Например, простейший представитель – муравьиная кислота НСООН – бесцветная жидкость с т. кип. 101 °С, а чистая безводная уксусная кислота CH3COOH при охлаждении до 16,8 °С превращается в прозрачные кристаллы, напоминающие лед (отсюда ее название ледяная кислота).
Простейшая ароматическая кислота - бензойная C6H5COOH (т. пл. 122,4°С) - легко возгоняется, т.е. переходит в газообразное состояние, минуя жидкое. При охлаждении её пары сублимирутся в кристаллы. Это свойство используется для очистки вещества от примесей.
Растворимость карбоновых кислот в воде обусловлена образованием межмолекулярных водородных связей с растворителем:
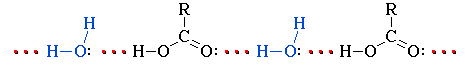
Низшие гомологи С1-С3 смешиваются с водой в любых соотношениях. С увеличением углеводородного радикала растворимость кислот в воде уменьшается. Высшие кислоты, например, пальмитиновая C15H31COOH и стеариновая C17H35COOH – бесцветные твердые вещества, не растворимые в воде.
Карбоновые кислоты проявляют высокую реакционную способность. Они вступают в реакции с различными веществами и образуют разнообразные соединения, среди которых большое значение имеют функциональные производные, т.е. соединения, полученные в результате реакций по карбоксильной группе.
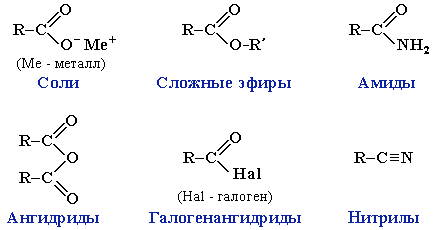
Образование солей происходит при действии на карбоновые кислоты:
а) активных металлов 2RCOOH + Mg  (RCOO)2Mg + H2↑ (RCOO)2Mg + H2↑
| |
б) аммиака RCOOH + NH3 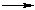 RCOONH4 RCOONH4
| |
в) основных оксидов 2RCOOH + CuO 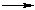 (RCOO)2Cu + H2O (RCOO)2Cu + H2O
| |
г) гидроксидов металлов и аммония RCOOH + NaOH 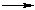 RCOONa + H2O RCOONa + H2O
| |
д) солей более слабых кислот 2RCOOH + Na2CO3 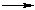 2RCOONa + H2O + CO2 2RCOONa + H2O + CO2
|
Названия солей составляют из названий остатка RCOO– (карбоксилат-иона) и металла. Например, CH3COONa – ацетат натрия, (HCOO)2Ca – формиат кальция, C17H35COOK – стеарат калия и т.п.
Более сильные кислоты способны вытеснять карбоновые кислоты из их солей:
CH3COONa + HCl 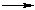 CH3COOH + NaCl
CH3COOH + NaCl
2. Образование сложных эфиров R–COOR':
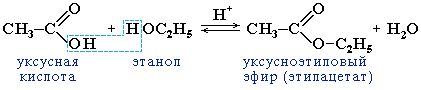
Реакция образования сложного эфира из кислоты и спирта называется реакцией этерификации (от лат. ether – эфир).
3. Образование амидов:
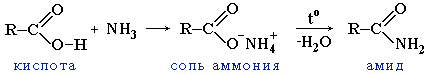
Вместо карбоновых кислот чаще используют их галогенангидриды:
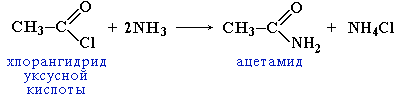
Амиды образуются также при взаимодействии карбоновых кислот (их галогенангидридов или ангидридов) с органическими производными аммиака (аминами):
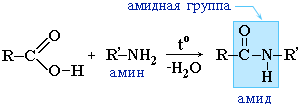
Амиды играют важную роль в природе. Молекулы природных пептидов и белков построены из α-аминокислот с участием амидных групп – пептидных связей.
 2014-01-31
2014-01-31 757
757








