Механизм действия ферментов. Основные черты
При ферментативном катализе фермент обратимо соединяется с субстратом, в результате образуется нестойкий ферментсубстратный комплекс (ES).
На первых этапах носит обратимый, а затем необратимый характер. Потом распадается на фермент и продукт реакции.
Е +S<-------------------à E S* --------à Eр -------à Е+ р
Так как ES существует, в течение конечного промежутка времени может быть и так, что все молекулы фермента связаны в ES (при условии, что концентрация субстрата высокая - субстрат в избытке) — говорят о максимальной скорости ферментативной реакции. Теория Фишера подразумевает жёсткое соответствие между активным центром и субстратом («ключ» - «замок»), т.е. каталитический центр заранее подготовлен к форме субстрата.
Теория Кошланда (теория индуцированного соответствия). Подразумевает гибкость каталитического центра, т.е. каталитически активная конформация фермента и субстрата может возникать в момент присоединения субстрата, до него геометрическое соответствие АЦ и субстрата приблизительное.

|

|
Гипотеза индуцированного соответствия предполагает между ферментом и субстратом
не только геометрического соответствия, но и электрическое.
Основные черты:
1. АЦ формируется из участков ППЦ и отдельных аминокислотных остатков. Субстрат соединяется с АЦ в нескольких точках, это обеспечивает высокую избирательность связывания (комплиментарность субстрата и АЦ) и ориентацию субстрата, необходимую для катализа.
2. АЦ составляет небольшую часть молекулы фермента, располагается в углублении
(нише) поверхности фермента. Ниша - гидрофобная. Субстрат, соединяясь с АЦ,
оказывается не в водной среде, а в специфическом окружении функциональных
групп АЦ.
3. В ходе присоединения субстрата и в ходе катализа происходят конформационные
изменения молекулы фермента и субстрата, до взаимодействия конформации
соответствуют лишь незначительно. Строгая комплиментарность возникает при
взаимодействии в результате изменения конформации (индуцированное
соответствие)
Конформационные изменения могут способствовать «растягиванию», разрыву связи или сближению молекул в реакциях синтеза, тем самым, ускоряя реакцию. Специфичность.
1. субстратная (структура АЦ комплиментарна только 1 субстрату) Пример: АЦ
фермента гистидаза комплиментарен гистидину и катализирует его превращения.
2. групповая (катализируют однотипные превращения сходных по строению
веществ). Пример: липаза гидролизует жиры с различными жирными кислотами.
3. стереоспецифичность (превращение лишь одного из стереоизомеров). Пример:
цис-изомер фумаровой кислоты - малеиновая кислота не может быть субстратом
для фумаразы.
Единица ферментативной активности (с. 157)
За единицу фермента принимают такое его количество, какое катализирует превращение
1 ммоль вещества за 1 мин.[1 Ед].
Удельная активность фермента — число единиц фермента на массу белка в мг. В образце.
Молярная активность указывает сколько молекул субстрата превращает 1 моль фермента
за 1 минуту (число оборотов).
Регуляция активности ферментов. Выделяют 4 типа регуляции:
1. Частичный протеолиз (Трипсиноген------àТрипсин)
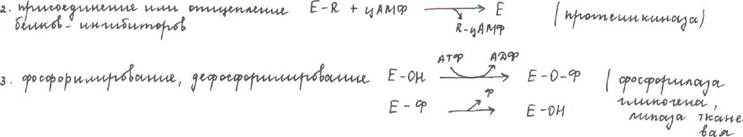
4. Аллостерическая (фосфофруктокиназа, изицитратдегидрогеназа)
«Ферменты - основа жизни» (Павлов)
В обмене веществ ферменты играют первостепенную роль. В основе заболеваний лежит изменение какой-либо ферментативной реакции, если ингибировать хотя бы 1 фермент наступает смерть.
 2014-01-31
2014-01-31 924
924








