Явление неправильных рядов. Это явление наблюдается при введении в коллоидные системы электролитов, содержащих многовалентные ионы с зарядом, противоположным заряду коллоидной частицы. При добавлении к отдельным порциям золя различных все возрастающих количеств электролитов золь сначала остается устойчивым, затем в определенном интервале концентраций происходит коагуляция, далее золь снова становится устойчивым и, наконец, при высоком содержании электролита опять наступает коагуляция, уже окончательная.
Явление неправильных рядов объясняется тем, что при малых количествах введенного электролита многовалентных ионов недостаточно, чтобы скоагулировать золь. При этой концентрации электролита x-потенциал частиц выше его критического значения. При несколько больших количествах электролита его ионы уже проявляют коагулирующее действие. Этот интервал концентраций отвечает значениям электрокинетического потенциала частиц от xкрит. одного знака до xкрит. противоположного знака.
При еще несколько больших концентрациях многовалентные ионы перезаряжают коллоидные частицы и золь становится опять устойчивым. В этой зоне x-потенциал снова выше критического значения, но противоположен по знаку x-потенциалу частиц исходного золя. Наконец, при высоком содержании введенного электролита многовалентные иона снова и уже окончательно коагулируют золь по механизму концентрационной коагуляции.
Для золей с отрицательно заряженными частицами и многовалентных катионов вышеуказанную зависимость иллюстрирует схема на рис. 9.5.
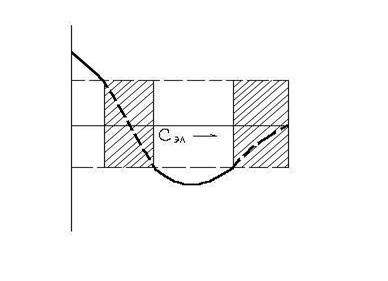 Рис. 9.5. Чередование зон устойчивости и неустойчивости при введении в золь электролита с многовалентными катионами. Зоны неустойчивости заштрихованы
Рис. 9.5. Чередование зон устойчивости и неустойчивости при введении в золь электролита с многовалентными катионами. Зоны неустойчивости заштрихованы
Явление неправильных рядов известно давно. Чередование зон устойчивости и неустойчивости лиозолей при добавлении многовалентных ионов вполне закономерно, и поэтому термин “неправильные ряды” должен рассматриваться как условный.
Антагонизм и синергизм электролитов. Эти явления можно наблюдать при коагуляции золей смесями некоторых электролитов. Эти явления имеют большое практическое значение, так как при добавлении к системе даже одного коагулятора благодаря содержанию в системе стабилизирующего электролита коагуляция проходит в действительности под влиянием по крайней мере двух электролитов. В технике же для коагуляции применяют смеси нескольких электролитов.
При коагуляции золя смесью двух электролитов наблюдается три предельных случая.
1. Аддитивное действие электролитов. На рис. 9.6 этот случай характеризуется кривой 1, соединяющей значения порогов коагуля-ции g1 и g2 каждым электролитом (на оси абсцисс нанесены значения концентраций электролита, на оси ординат – значения концентраций другого). Электролиты действуют как бы независимо друг от друга.
2. Антагонизм электролитов (кривая 2). Электролиты как бы противодействуют друг другу и для коагуляции золя их нужно добавлять больше, чем это требуется по правилу аддитивности.
3. Синергизм электролитов (кривая 3). Электролиты как бы способствуют друг другу, и для коагуляции золя их требуется меньше, чем это нужно по правилу аддитивности.
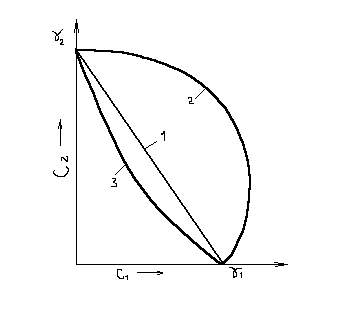
Рис. 9.6. Антагонизм и синергизм при коагулирующем действии электролитов
Аддитивность обычно наблюдается при сходстве коагулирующей способности обоих электролитов (т. е. когда они содержат противоионы одинаковой валентности), антагонизм – при большом различии в коагулирующем действии электролитов. Условия, при которых наблюдается синергизм, трудно сформулировать.
 2014-01-31
2014-01-31 1054
1054
