Различают быструю коагуляцию, при которой все сближения частиц, находящихся в броуновском движении, кончаются их слипанием и скорость не зависит от концентрации электролита. При медленной коагуляции вследствие того, что на поверхности коллоидных частиц частично сохраняется двойной электрический слой, сольватная оболочка и т. д. слипание частиц происходить лишь в результате особо удачных сближений и скорость зависит от концентрации коагулирующего электролита. Эта зависимость показана на рисунке 9.1.
Область АО отвечает устойчивости коллоидной системы, здесь скорость коагуляции практически равна нулю. АВ – область медленной коагуляции, скорость растет с увеличением концентрации до некоторого предельного значения. Точка А соответствует порогу коагуляции, т.е. наименьшей концентрации при которой начинается коагуляция. Дзета – потенциал в этой точке имеет критическое значение. Точка Б характеризует собой ту концентрацию, после которой дальнейшее повышение концентрации электролита уже не оказывает влияние на скорость коагуляции, так как z-потенциал частиц - становится равным нулю. Вправо от точки Б находится область быстрой коагуляции, где скорость коагуляции не зависит от концентрации электролита.
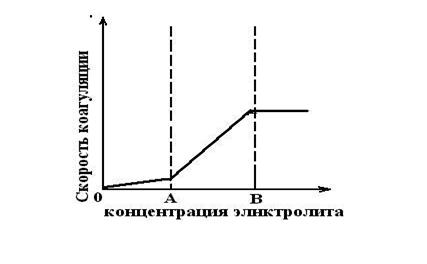
Рис. 9.1 Зависимость скорости коагуляции от концентрации электролита
Теорию быстрой коагуляции разработал польский ученый Смолуховский. Скорость коагуляции является функцией счетной концентрации золя n от интенсивности броуновского движения, характеризуемой коэффициентом диффузии D, и от критического расстояния r, на которое должны приблизиться друг к другу центры двух частиц, чтобы произошло их слипание. Расстояние r может превышать диаметр коллоидных частиц. При расстояниях, больших r, Смолуховский полностью пренебрегал действием молекулярных сил притяжения на броуновское движение частиц и на процесс их сближения.
При быстрой коагуляции агрегация идет таким образом, что первоначальные одинарные частицы при столкновении образуют двойные, затем тройные и т. д. Обозначая n1, n2, n3 как численные концентрации частиц, состоящих из одной, двух, трех и т. д. первоначальных частиц, можно написать, что, когда время t = 0, n1 = n0 и n2 = n3 = ¼ nп = 0. По истечении времени t n = nt = n1 + n2 = n3 = ¼ (n – конечная численная концентрация). При этом будет соблюдаться неравенство n < n0. Поскольку при быстрой коагуляции каждое столкновение двух частиц приводит к их слиянию, механизм коагуляции можно уподобить механизму химической реакции второго порядка:
–di/dt = Kn2, (9.1)
(K – константа, характеризующая вероятность сближения).
Константа К зависит от интенсивности броуновского движения, т. е. от константы диффузии D и от расстояния r, на котором действуют силы притяжения. Ее можно выразить так:
К = 4pDr. (9.2)
Перепишем уравнение (9.1) в виде –dn/n2 = Kdt и проинтегрируем его в пределах от n0 до n и от 0 до t, получим: 1/n – 1/n0 = Кt, откуда численная концентрация золя в момент t будет равна:
n = n0/1 + Кn0t. (9.3)
Вводя время половинной коагуляции q, получаем:
Кn0 = 1/q. (9.4)
Тогда основное уравнение (9.3) можно представить так:
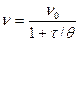 . (9.5)
. (9.5)
Зная n0 и n для различных значений t, можно вычислить К и q.
Графическая зависимость относительных изменений общего числа частиц å n и числа частиц n1, n2, n3 ¼ в единице объема золя от t/q показана на рис (9.2). Число одинаковых частиц, оставшихся ко времени t, будет составлять
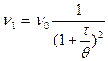 . (9.6)
. (9.6)
Число двойных частиц, образовавшихся ко времени t,
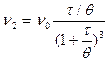 . (9.7)
. (9.7)
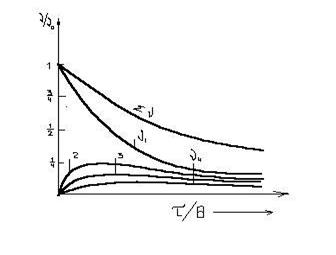 Рис. 9.2. Кривые распределения числа частиц
Рис. 9.2. Кривые распределения числа частиц
В начальный момент, когда t = 0, все частицы одиночные: ån = n1 = n0, а n2 = n3 = ¼= 0. Через некоторое время t число одиночных частиц n1 уменьшилось, но появились двойные, тройные и т. д. С течением времени и они исчезают, а появляются частицы более высокого порядка – более крупные агрегаты. Кривые, представленные на рис. 9.2, показывают, что число первичных частиц уменьшается быстрее, чем общее число частиц. Для всех укрупненных частиц кривые проходят через максимумы, высота которых уменьшается по мере укрупнения.
Теория Смолуховского получила экспериментальное подтверждение в многочисленных исследованиях, что является прекрасным доказательством правильности основных представлений теории диффузии и броуновского движения. Теория Смолуховского позволяет также вычислить расстояние r, на которое должны приблизиться центры двух частиц для того, чтобы произошло их слипание.
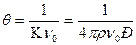 | (9.8) |
и, согласно Эйнштейну,
D = kT 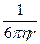 , , |
где k – константа Больцмана; h –динамическая вязкость дисперсионной среды; r – радиус частицы. Комбинируя два последних уравнения получаем:
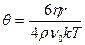 или
или 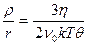 . (9.9)
. (9.9)
Теория Смолуховского разработана для быстрой коагуляции, им было сделано предположение, что она пригодна и к медленной коагуляции, когда частицы не полностью астабилизованы. Для этого в уравнение (9.3) следует ввести эффективность сближения e.
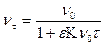 . (9.10)
. (9.10)
Однако, как следует из теории медленной коагуляции Фукса, параметру e надо придать другой смысл, так как понятие эффективности сближения неприменимо к процессу сближения частиц, совершающих броуновское движение. Теория Смолуховского предполагает, что до сближения частиц на расстояние r между ними нет никаких сил взаимодействия.
Фукс для учета сил дальнодействия частиц как функции от расстояния их центров R дополнил формулу членом, выражающим дрейф частицы по направлению к центральной частице под влиянием сил притяжения F:
Q = 4pR2(D’dn/dr + 2bFn), (9.11)
где Q – число частиц, проходящих за единицу времени через поверхность сферы S радиуса R по направлению к центральной частице; D –удвоенный коэффициент диффузии, b – подвижность частицы в вязкой среде, равная отношению ее скорости к действующей силе, цифра 2 перед b введена потому, что обе частицы движутся навстречу друг другу.
Согласно Эйнштейну, b = D/kT, следовательно, 2b = D’/kT. Заменим силу F на dU/dR (где U – потенциальная энергия молекулярного взаимодействия двух частиц) и, интегрируя уравнение (9.11), получим
Q = 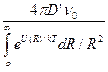 . (9.12)
. (9.12)
Уравнение (9.12) было выведено Фуксом первоначально для аэрозолей с целью учета ускорения коагуляции под влиянием притяжения разноименно заряженных частиц. В этом случае потенциальная энергия взаимодействия отрицательна и скорость коагуляции возрастает. В общем случае из (9.12) можно получить уравнение
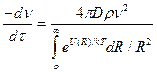 . (9.13)
. (9.13)
Интересно сопоставить время быстрой и медленной коагуляции. Для концентрированного золя AgI (1 моль/л), содержащего в 1 мл 4 ∙ 1014 частиц (r = 30 ммк), получим q = 5 10-4 с. При меньшей концентрации золя время быстрой коагуляции изменяется от 1 с до 1 мин.
Медленная коагуляция идет часами и сутками. В золе металлического селена с добавлением 50 ммоль/л KCl быстрая коагуляция заканчивается за 20 с, а медленная – за 55 часов.
 2014-01-31
2014-01-31 1249
1249
