Запрет Паули
Тема 2. Строение атомов элементов.
Правило Дюлонга и Пти.
Законы, описывающее поведение газов.
Закон Авогадро: в равных объемах газа при одинаковых условиях содержится равное количество молекул.
Следствие: при нормальных условиях 1 моль любого газа занимает объем 22,4 л.
Нормальные условия: атм. давл. = 101,3кПа, t = 00С = 273,15 К.
Закон Авогадро позволяет ввести величину относительной плотности одного газа от другого. Эта величина часто используется при решении различных химических задач и она равна отношению масс двух газов, взятых в равных объемах при одинаковых количествах.
D=m1/m2=M1/M2
D=(H2)=Mx/2 г/моль
Газообразное стояние характеризуется значительными расстояниями по сравнения с размерами частиц газа. Взаимодействие частиц в газовой фазе осуществляется при их столкновении. Вероятность столкновений растет при уменьшении объема и увеличении давления и температуры, поэтому эти 3 величины имеют наиболее важное значение для описания газового состояния.
По закону Бойля-Мариотта; Давление (Р) * Объем (V) = const.
По О Шарль: V=(V0/273,15)*T.
По Гейлюсаку: Р=(Р0/273,15)*T
Все эти 3 величины могут быть объединены:
PV/T=P0V0/T0
Более общий характер носит уравнение Менделеева – Клапейрона:
PV=(m/M)RT
PV=υRT
R – универсальная постоянная = 8,3 Дж/моль К.
Теплоемкость – отношение количества теплоты полученной веществом при нагревании или отданной при охлаждении к изменению температуры, которая при этом происходит.
Учитывая, что для большинства металлов теплоемкость остается постоянной величиной, Дюлонг и Пти предложили правило: произведение атомной массы металла на его удельную теплоемкость, есть величина постоянная и равная 26 кДж/моль К.
Исходя из этой величины легко можно рассчитывать атомные массы металлов, но так как правило носит приближенные характер, расчет ведется в 2 этапа:
1. Определяют приближенное значения атомной массы металла, затем эквивалент металла, проводят деление приближенного значения атомной массы на эквивалент и получают валентность.
2. Полученное значение округляем для целого и затем перемножить значение эквивалента и валентности, получаем точную атомную массу.
В атоме не может быть двух электронов, имеющих одинаковые значения всех четырёх квантовых чисел.
Таким образом, запрет Паули определяет электронную ёмкость орбиталей, подуровней и уровней.
Электронная ёмкость уровней рассчитывается по формуле:
N = 2n2,
где N – число электронов на данном уровне,
n – главное квантовое число.
На данном энергетическом подуровне электроны располагаются таким образом, чтобы их суммарный спин был максимальным.
| 7N | 1S2 2S2 2p3 | |
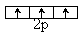
| ΣS = ± 1/2 · 3 = 1,5 |
 2014-01-31
2014-01-31 787
787








