Тема 4. Химическая связь и строение молекул.
Атомы являются простыми частицами, не существующими самостоятельно.
Атомы объединяются в более сложные частицы:
· молекулы(С3, Н8, О3),
· радикалы (С2Н5-),
· ионы (NН4+).
Те силы и механизмы, которые заставляют атомы объединяться в сложные частицы, называют химической связью. От типа химической связи зависит основные свойства вещества.
Электропроводность:
| Сu | NaCl | C12H22O11 |
| в любом виде проводит ток | в жидком виде проводит ток | не проводит ток |
Ионная связь объясняется следующим образом: атом - типичный металл - теряет свой валентный электрон, превращаясь в катион.
Атом – типичный неметалл - принимает электрон, превращаясь в анион.
Na0 – 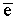 = Na+ (катион)
= Na+ (катион)
Cl0 + 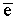 = Cl-- (анион)
= Cl-- (анион)
Ионная связь является максимально полярной. Она образуется атомами тех элементов, которые имеют максимально различные электроотрицательности, т. е. ионная связь образуется щелочными и щелочно-земельными металлами и галогенами:
KF; CaCl2; NaI.
Ионная связь имеет два основных свойства:
· ненаправленность,
· ненасыщаемость.
Эти два свойства тесно связанны между собой.
Два иона: катион и анион полностью не могут компенсировать силовые поля друг друга, поэтому для компенсации своих зарядов каждый ион вынуждает притягивать из пространства дополнительные ионы противоположного знака.
В этом заключается ненасыщаемость.
Так как электрическое поле иона имеет сферический характер, то для ионной связи характерна ненаправленность.
Благодаря тому, что энергия ионизации больше энергии сродства к электрону, полного перехода электронов не происходит даже в случае атомов с очень большой разностью электроотрицательности. Таким образом, соединений с чисто ионной связью не существует. Можно говорить лишь о доле ионной связи.
В силу особенностей ионной связи, т.е. её полярности, ненаправленности и ненасыщаемости, молекулы с ионной связью являются достаточно относительным понятием.
В водных растворах и расплавах ионные молекулы полностью диссоциированы на ионы:
AB=A++B-.
Двух- и трёхионных соединений не существует, а весь кристалл ионного соединения можно рассматривать как молекулу, состоящую из огромного числа ионов:
AmBn.
 2014-01-31
2014-01-31 761
761








