Метод молекулярных орбиталей (ММО) позволяет объяснить ряд противоречий, которые нельзя объяснить, используя метод валентных связей.
Например, образование молекулы кислорода О2 описывается методом валентных связей как результат создания двух общих электронных пар:
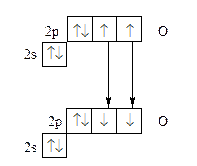
Согласно такому описанию, молекула О2 не содержит неспаренных электронов. Однако магнитные свойства кислорода указывают на то, что в молекуле О2 имеются два неспаренных электрона.
Согласно методу валентных связей, все ковалентные связи осуществляются общей парой электронов. Между тем, ещё в конце прошлого века было установлено существование довольно прочного молекулярного иона водорода 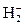 : энергия разрыва связи составляет здесь 2,65эВ. Однако никакой электронной пары в этом случае образовываться не может, поскольку в состав иона
: энергия разрыва связи составляет здесь 2,65эВ. Однако никакой электронной пары в этом случае образовываться не может, поскольку в состав иона 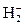 входит всего один электрон. Таким образом, метод валентных связей не даёт удовлетворительного объяснения существованию иона
входит всего один электрон. Таким образом, метод валентных связей не даёт удовлетворительного объяснения существованию иона 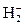 .
.
 2014-01-31
2014-01-31 719
719








