Под механизмом реакции подразумевается подробное описание процесса, в результате которого реагенты превращаются в продукты.
Изучение механизма реакции включает в себя исследование(или умозрительное предположение):
- этапов реакции
- электронного и пространственного строения промежуточных частиц, которые образуются во время реакции.
Механизм реакции должен быть подтвержден экспериментально с использованием нескольких соединений гомологического ряда или веществ, отличающихся только заместителями. В процессе познания представления о механизме реакции могут изменяться или даже полностью отвергаться. Для некоторых реакций на данном этапе развития науки, может быть предложено несколько механизмов, каждый из которых имеет свои подтверждения.
Если механизм реакции изучен и подтвержден, то делают дополнение к типу реакции,
указывая электронную природу активных промежуточных частиц, определяющих механизм реакции:
А Е - реакция электрофильного присоединения
А Nu - реакция нуклеофильного присоединения.
S Е - реакция электрофильного замещения
S R -реакция радикального замещения
Реакционная способность- тип реакции и электронная природа промежуточных активных частиц- зависит от строения биоорганического соединения, типа связей.
Например, для непредельных соединений характерны реакции А Е, для ароматических соединений - S Е, спиртов - S N.
4.2.1. Реакции электрофильного присоединения в ряду алкенов(А Е)
Характерны для алкенов, содержащих изолированные и сопряженные двойные связи.
В реакциях могут участвовать галогены, галогеноводороды, спирты, карбоновые кислоты, вода. Присоединение воды- гидратация- наиболее важный вид реакций in vivo.
Вспомним реакции, которые изучают в школьной программе органической химии:
А) Присоединение галогенов- дигалогенирование. Обычно используют раствор галогена в СС14. Обесцвечивание раствора бромной воды- качественная реакция на двойную связь.
> CH=CH< + Вг2 —> > CH Вг — СHВг< дибромалкан
Б) Присоединение галогеноводорода- гидрогалогенирование
> CH=CH< +НВг —> > CH2 — СHВг< бромалкан
В) Присоединение воды. В отличие от предыдущих реакций происходит в условиях кислотного катализа, чаще используют серную кислоту
Н2 S О4
> CH=CH< +НОН ——> > CH2 — СH<
|
ОН алканол(спирт)
Если двойная связь несимметричная, то для оценки направления реакции используют эмпирическое (опытное) правило Марковникова (empeiria- греч- опыт): атом водорода присоединяется к более ”гидрированному“ атому углерода, если рядом с двойной связью расположен заместитель-донор.
СН2 = СН— СН3 + НС1 ——> СН3 — СН — СН2Н
пропен | 2-хлорпропан
С1
Реакция идет против правила Марковникова, если рядом с двойной связью располагается заместитель- акцептор.
СН2 = СН— СООН + НС1 ——> СН2 — СН — СООН
пропеновая кислота | | 3-хлорпропановая кислота
С1 Н
Для объяснения правила Марковникова можно использовать два объяснения, используя знание о распределении электронной плотности в молекуле:
1. статическое - изначальное распределение
2. динамическое - возникающее в процессе реакции, которое связано с конкретным механизмом реакции.
В молекулах пропена и пропеновой (акриловой) кислоты различное распределение электронной плотности, в соответствии с этим распределением происходит присоединение заряженных частиц (Н+ и С1–)
б – б+
СН2 = СН <— СН3 СН2 = СН —> СООН
донор (+I) акцептор (-I)
Механизм реакции А Е
Реакционный процесс можно представить в виде нескольких стадий:
1. атака электрофилом двойной связи
2. образование π -комплекса
3. превращение π -комплекса в σ- комплекс(карбокатион). Из двух возможных
карбокатионов образуется более устойчивый
4. присоединение нуклеофила, образование конечного продукта реакции
Положительно заряженная частица электрофил(чаще всего Н+) ориентируется около электронов двойной связи, которые располагаются перпендикулярно σ- скелету. В поле притяжения электрофила находится отрицательно заряженный нуклеофил(в нашем конкретном случае Вг – ). Затем протон образует химическую σ - связь с одним из двух атомов углерода. Для образования связи нужна пара электронов. Поэтому соседний атом теряет свой электрон и приобретает заряд (+), получается карбокатион. Всегда возможно образование двух карбокатионов. Далее в реакции присоединения нуклеофильной частицы участвует тот карбокатион, который более устойчив. Нуклеофильная частица присоединяется с противоположной стороны по отношению к протону.
На схеме представлены два возможных пути присоединения протона Н+ после образования π –комплекса (карбокатионы I и II).
Более устойчивым является карбокатион I, поскольку заряд (+) который соответствует свободной электронной орбитали - компенсируется донорным действием двух соседних радикалов(метильных групп), а в карбокатионе II – только со стороны одного радикала (этильной группы).
При исследовании реакции присоединения бромоводорода к пропену установлено, что полностью образуется 2-бромпропан, и не обнаружено образование другого изомера.
Схема механизма реакции А Е
π –комплекс σ- комплекс-карбокатион
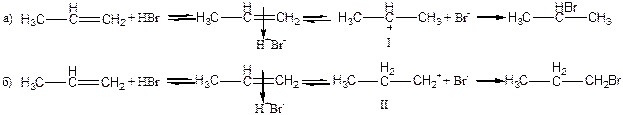 π –комплекс σ- комплек-карбокатионс
π –комплекс σ- комплек-карбокатионс
Донорные заместители увеличивают скорости реакций присоединения., а акцепторные – снижают, так как уменьшают электронную плотность в области двойной связи и затрудняют притяжение электрофильной частицы при образовании π –комплекса.
Сравним относительные скорости реакций присоединения брома к двойной связи:
Этен 1, 0 (стандарт)
Пропен 3, 0
Метилпропен(изобутен) 5, 5
2-метилбутен-2 10,4
Бромэтен 0,04 (+ М < - I)
В организме с участием ферментов непрерывно протекают реакции присоединения воды к двойной связи. Эти процессы связаны с энергетическим обменом (реакции цикла Кребса), синтезом и окислением высших карбоновых кислот. Реакции стереоспецифичны, что означает - образуется только один стереоизомер.
Фумаровая кислота + Н2О ——> D- яблочная кислота
СООН
Н СООН |
> С=С < Н –С – ОН
НООС Н |
СН2
|
СООН
Гидратация активных форм 2,3-непредельных кислот всегда приводит к получению 3-гидроксипроизводных (ß -гидроксикарбоновых кислот).
СН 3 – СН = СН – СООН + Н2О ——> СН 3 – СН – СН2 – СООН
2-бутеновая кислота | 3-гидроксибутановая
(кротоновая) ОН (ß –гидроксимасляная)
Задание для самостоятельной работы: запишите строение двух возможных σ – комплексов(карбокатионов), которые образуются при гидратации пропеновой (акриловой) кислоты, обсудите, какой из них более устойчив и сравните ваши выводы с направлением реакции, которая сопровождается образованием 3-гидроксипропановой кислоты.
 2014-01-31
2014-01-31 1231
1231
