к карбонильной группе альдегидов и кетонов (АN)
В карбонильной группе присутствуют две связи π и σ распределение электронной плотности, неравномерное вследствие различной электроотрицательности атомов углерода и кислорода, которые находятся в sp2 – гибридном состоянии. Создаются два центра, которые отзываются на активные частицы с противоположными зарядами (+) и (-)
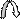 |
б+ б–

 > С = О
> С = О
электрофильный центр нуклеофильный центр
атакует частица (-) или с атакует частица (+),
повышенной электронной электрофил Е+.
плотностью, нуклеофил Nu
Донорные заместители подают электронную плотность в сторону атома углерода и снижают величину заряда б+. Акцепторные заместители смещают электронную плотность от атома углерода и увеличивают заряд б +, усиливая поляризацию связи (условно изображены разные величины частичных зарядов).
б+ б+
R —> СН = О R<— СН = О
донор акцептор
Акцепторные заместители должны увеличивать скорости реакций, а донорные заместители- уменьшать.
Химические свойства карбонильных соединений:
1. реакции нуклеофильного присоединения к карбонильной группе
2. электрофильные реакции замещения у атома углерода в соседнем, α – положении к карбонильной группе.
Реакции нуклеофильного присоединения
Карбонильные соединения реагируют с достаточно большим количеством
нуклеофилов:
НОН, RОН, НСN, RSН, Н2S, RNН2, НС1, НВг, NаНSО3(натрия гидросульфит), RNHNH2 (гидразин).
Механизм реакции становится ясным, если представить схему процесса и образование двух возможных промежуточных соединений:
А) Первым атакует (Е+) электрофил. Образуется карбокатион, на атоме углерода появляется заряд (+). Атом углерода имеет гибридизацию sp2 и тригональное строение.
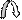 б + б - (+)
б + б - (+)
> С = О + Е+ Nu– — —> > С — О — Е
Б)Первым атакует (Nu–) нуклеофил. Образуется анион, отрицательный заряд локализован на атоме кислорода, атом углерода тетраэдрический, гибридизация sp3, образует 4 ковалентные связи.
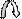 б+ б-
б+ б-
> С = О + Е+ Nu– — —> > С — О (-)
|
Nu
Понятно, что анион(вариант Б) является более устойчивым,, чем карбокатион
(вариант А). Известно множество примеров существования устойчивых анионов:
гидроксид НО –, анионы неорганических и органических кислот RCOO–.
Поэтому реакции с участием карбонильной группы проходят по механизму нуклеофильного присоединения. Для большинства реакций требуется кислая среда, которая способствует образованию карбокатиона, к которому легко присоединяется
нуклеофильная частица.
б+ б- + Nu
> С = О + Н+ — —> > С – О —Н + — —> > С — О– + Н+
|
Nu
1. Присоединение воды. Обратимая гидратация карбонильной группы происходит при растворении альдегида в воде, образуются гем-диолы, которые существуют только в растворе. Формальдегид гидратирован на 100%, ацетальдегид- на 58%, ацетон – менее 1%. Эти данные доказывают снижение реакционной способности карбонильной группы под влиянием заместителей с (+) индуктивным эффектом. Водный раствор формальдегида- формалин, w=40%, используется для изготовления анатомических и гистологических препаратов.
R—СН = О + НОН <=> R—СН – ОН
|
ОН гидрат альдегида
Трихлорэтаналь(жидкость, Т кип. 970) присоединяет воду и существует в виде устойчивого кристаллического соединения- хлоралгидрата СС13 СНО • Н2О, который использовали как успокаивающее и снотворное средство, и сейчас применяют в ветеринарии. Пример этого соединения подтверждает, что заместители с (–) индуктивным эффектом увеличивают реакционную способность карбонильной группы и устойчивость продуктов присоединения.
ОН
|
С13С- СНО + НОН —> С13 С– С – ОН
трихлорэтаналь | хлоралгидрат
ОН
 2014-01-31
2014-01-31 765
765








