На практике исследование скорости химических реакций начинают с определения порядков этой реакции по каждому из реагирующих веществ и (или) порядка реакции в целом. Для реакции с участием нескольких веществ определить 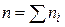 можно только поэтапно, определяя порядки по отдельным веществам. Для этого используется метод избытка (метод изоляции, метод Оствальда), а затем определяют ni любым из описанных ниже методов.
можно только поэтапно, определяя порядки по отдельным веществам. Для этого используется метод избытка (метод изоляции, метод Оствальда), а затем определяют ni любым из описанных ниже методов.
Метод изоляции или метод избытка.
Если в исследуемой реакции участвуют несколько реагирующих веществ, то общий порядок реакции 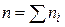 , где ni - порядок по каждому из участников. Частный порядок ni можно определить, взяв все вещества, кроме данного, взять в большом избытке. Так, в случае реакции
, где ni - порядок по каждому из участников. Частный порядок ni можно определить, взяв все вещества, кроме данного, взять в большом избытке. Так, в случае реакции
А + В + С ® D
скорость равна
 .
.
Если вещества В и С взяты в большом избытке, то при протекании реакции их концентрации практически не изменяются, т.е.
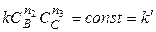 .
.
И
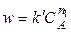 .
.
Тогда, определив порядки реакции по каждому из реагирующих веществ, можно найти общий порядок реакции:
n = n 1 + n 2 + n 3.
Метод подстановки.
Этот метод заключается в том, что опытные результаты - текущие концентрации веществ в моменты времени t - последовательно подставляются в интегральные кинетические уравнения реакций нулевого (7), первого (9), второго (12 или 14) порядков и определяется, какое из уравнений дает практически постоянную величину константы скорости. Именно это уравнение и определяет порядок исследуемой реакции.
Графический вариант метода подстановки.
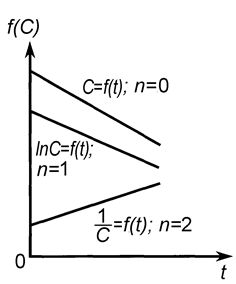
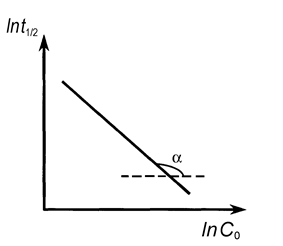
| Рис. 9. Линейные зависимости различных функций концентрации реагирующих веществ от времени. | Рис. 10. Определение порядка реакции по зависимости времени полупревращения от начальной концентрации |
Графический метод состоит в построении зависимостей различных функций концентрации от времени и определения, для какой из них наблюдается прямолинейная зависимость.
Линейные зависимости для реакций различных порядков получаются в следующих координатах (рис. 9): нулевого порядка С = f (t), первого порядка ln С = f (t), второго порядка 1/ С = f (t).
Для реакций более высоких порядков выбираются координаты 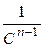 - t.
- t.
Метод определения порядка реакции по времени полупревращения.
Порядок реакции определяется на основе опытной зависимости времен полупревращения (t 1/2) от начальных концентраций веществ (C 0).
Как уже отмечалось, для n = 0 время полупревращения прямо пропорционально величине С0, для n = 1 - не зависит от С0, а n = 2 - обратно пропорционально С0. Для реакции любого другого порядка справедливо соотношение (20)
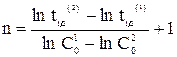 , (20)
, (20)
где t 1/2(1) и t 1/2(2) - время полупревращения при начальных концентрациях С 01 и С 02, соответственно.
Возможен графический вариант метода: по оси ординат откладываются значения ln(t 1/2), а по оси абсцисс - значения ln C 0 (рис. 10), тогда n = - tga + 1.
Дифференциальный метод Вант-Гоффа.
Этот метод применяют, когда в реакции участвует одно вещество, или при участии нескольких веществ, когда все вещества, кроме данного (А), взяты в большом избытке. Тогда скорость реакции равна
 . (21)
. (21)
Прологарифмируем уравнение (21):
lnw = lnk + n lnС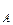
Очевидно, что в координатах lnw- lnC мы получим линейную зависимость, причем n = tga.
Построив зависимость lnw от lnC (рис. 11), можно определить порядок реакции, равный в данном случае тангенсу угла наклона прямой (n = tga).
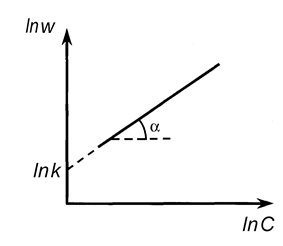
Рис. 11. Определение порядка реакции дифференциальным методом Вант-Гоффа.
 2014-02-02
2014-02-02 33913
33913
